
【题目】在15mL0.1molL﹣1KOH溶液中逐滴加入0.2molL﹣1甲酸溶液,溶液pH和加入甲酸(弱酸)的体积关系曲线如图所示,下列关系正确的是( ) 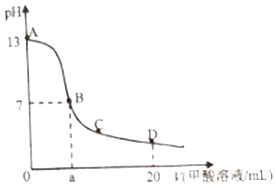
A.在B点:c(K+)=c(HCOO﹣)>c(OH﹣)=c(H+),且a=7.5
B.在A,B间任意一点,c(HCOO﹣)>c(K+)>c(OH﹣)>c(H+)
C.在D点:c(HCOO﹣)+c(HCOOH)>2c(K+)
D.B→C段:水的电离程度先增大后减小
【答案】C
【解析】解:A.当恰好中和时消耗0.2mol/L甲酸溶液7.5mL,反应生成甲酸钠溶液,溶液显示碱性,若溶液为中性,则c(OH﹣)=c(H+),根据电荷守恒c(K+)=c(HCOO﹣),由于溶液中存在部分甲酸,则应该满足a>7.5,故A错误;
B.在A、B间任意一点,因为开始时c(OH﹣)>c(HCOO﹣),即有可能存在:c(K+)>c(OH﹣)>c(HCOO﹣)>c(H+),故B错误;
C.D点甲酸过量,所加入甲酸的物质的量为:0.02L×0.2mol/L═0.004mol,KOH的物质的量为:0.015L×0.1mol/L=0.0015mol,根据物料守恒,则反应后溶液中一定满足:c(HCOO﹣)+c(HCOOH)>2c(K+),故C正确;
D.B点是甲酸钾和甲酸的混合溶液,在C点甲酸过量,溶液呈酸性,抑制水的电离,酸浓度增大水电离程度减小,故D错误;
故选C.


科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.含有共价键的化合物一定是共价化合物
B.在共价化合物中一定含有共价键
C.含有离子键的化合物一定是离子化合物
D.离子化合物中可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下描述
①冰的密度小于水,液态水中含有(H2O)n都是由于氢键所致
②不同种元素组成的多原子分子里的键一定都是极性键
③离子键就是阳离子、阴离子的相互引力
④用电子式表示MgCl2的形成过程:![]()
⑤H2分子和Cl2分子的反应过程就是H2、Cl2分子里的共价键发生断裂生成H原子、Cl原子,而后H原子、Cl原子形成离子键的过程
上述说法正确的是( )
A. ①②③④⑤ B. ①② C. ④ D. ①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。下列有关说法正确的是

A. 关闭 K2,打开 K1,滴加硫酸,则装置 B 中每消耗 1molNa2O2,转移电子数为NA
B. 关闭 K1,打开 K2,试剂 X 是酸性 KMnO4 或 FeCl3 溶液,均可证明 SO2 有还原性
C. 为防止环境污染,装置C和E中的试剂均取用饱和的石灰水
D. 实验过程中体现了硫酸的酸性、吸水性、难挥发性、强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家提出“绿色自由”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为:CO(g)+2H2(g)→CH3OH(g)+H2O(g)△H
(1)若在一个定温定容的容器中发生上述反应,反应达到平衡的标志是 .
A.CO2和CH3OH的浓度相等
B.H2的百分含量保持不变
C.容器内压强保持不变
D.3v正(H2)=v逆(H2O)
E.容器中混合气体的密度保持不变
(2)若将CO2和H2的混合气体分成五等份,将它们分别充入温度不同、容积相同的恒容容器中发生上述反应.反应相同时间后,测得甲醇的体积分数 (CH3OH)与反应温度T的关系如图1,则上述CO2转化为甲醇的反应的△H0(填“>”、“<”、“=”) 
(3)上述反应在实际生产中采用的温度是300℃,其目的是 .
(4)300℃时,将CO2与H2按1:3的体积比充入某密闭容器中,CO2的平衡转化率(a)与体系总压强(P)的关系如图2所示.回答问题: ①若其他条件不变,将A点的体积压缩至原来的一半,一段时间后反应再次达到平衡,与原平衡相比较下列说法正确的是 .
A.CO2的浓度减小
B.正反应速率增大,逆反应速率减小
C.CO2和H2的体积比仍然是1:3
D.H2的体积分数减小②B点平衡混合气体的平均摩尔质量为 22.7g/mol (保留一位小数).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备BaCl2的工艺流程图如下: 
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验.查表得
BaSO4(s)+4C(s) ![]() 4CO(g)+BaS(s)△H1=+571.2kJmol﹣1①
4CO(g)+BaS(s)△H1=+571.2kJmol﹣1①
BaSO4(s)+2C(s) ![]() 2CO2(g)+BaS(s)△H2=+226.2kJmol﹣1②
2CO2(g)+BaS(s)△H2=+226.2kJmol﹣1②
(1)气体用过量NaOH溶液吸收,得到硫化钠.Na2S水解的离子方程式为 .
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, ![]() = . [Ksp(AgBr)=5.4×10﹣13 , Ksp(AgCl)=2.0×10﹣10]
= . [Ksp(AgBr)=5.4×10﹣13 , Ksp(AgCl)=2.0×10﹣10]
(3)反应C(s)+CO2(g) ![]() 2CO(g)的△H2=kJmol﹣1 .
2CO(g)的△H2=kJmol﹣1 .
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com