
����Ŀ���мס�����λͬѧ��������ԭ��ط�Ӧ�������Ļ��˳�����˾�ʹ��þƬ����Ƭ���缫������ͬѧ���缫����6 mol��L-1 H2SO4��Һ�У���ͬѧ���缫����6 mol��L-1��NaOH��Һ�У���ͼ��ʾ��

��ش�:
��1���׳���������_______������________������Ӧʽ:________________��
��2���ҳ��и�����__________������__________���ܷ�Ӧ�����ӷ���_______��
��3������ס���ͬѧ����Ϊ������ԭ��صĵ缫����������ǽ������ɸ������ϵĽ���Ӧ�ȹ����������ϵĽ���������������жϳ�___��Ը�ǿ�����һ��жϳ�___��Ը�ǿ(��дԪ�ط���)��
��4���ɴ�ʵ�飬�ɵõ�������Щ��ȷ����?___(��д��ĸ���)��
a. ����ԭ��ط�Ӧ�жϽ������˳��ʱӦע��ѡ����ʵĽ���
b.þ�Ľ����Բ�һ�������Ľ�����ǿ
c.��ʵ��˵���������˳���ѹ�ʱ����û��ʵ�ü�ֵ
d.��ʵ��˵����ѧ�о������ӣ���Ӧ������Ӱ��ϴ����Ӧ��������������
��5������ʵ��Ҳ������֤������ֱ�����ý������˳���ж�ԭ����е�������������������______(�����ɿ����������ɿ���)��
���𰸡� �� þ Mg-2e��=Mg2+ �� þ 2Al+2OH-+2H2O![]() 2 AlO2��+3H2�� Mg Al a��d ���ɿ�
2 AlO2��+3H2�� Mg Al a��d ���ɿ�
����������1������þ��ʧ������������Al��������������þ����ʧȥ���ӵ�������Ӧ�������������ӷ�����ԭ��Ӧ��������ӦΪMg-2e-=Mg2+����2���ҳ�������������������Һ��Ӧ����ʧ������������þ������������������ԭ��Ӧ���ܷ�ӦΪ2Al+2OH-+2H2O��2AlO2��+3H2������3������þ���������������������������������Ľ���������ǿ�жϣ�����þ���ǿ�����������ǿ����4��a�����ݼס����е缫��Ӧʽ֪��ԭ�����������������Һ�йأ�a��ȷ��b��þ�Ľ����Դ���������ʧ�������׳̶���������Һ�йأ�b����c����ʵ��˵���������Һ����Ӱ��缫��������������˵���������˳��û��ʹ�ü�ֵ��c����d����ʵ��˵����ѧ�о������ӣ���Ӧ�������йأ��缫������ͬ�䷴Ӧ������ͬ��������ﲻͬ������Ӧ����������������d��ȷ����ѡad����5������ʵ��˵������ֱ�����ý������˳����жϵ���е��������������ɿ�������ǽ�һ�������ƣ�ͨ���۲���������ж�ԭ��ص���������


 Сѧ�̲�ȫ��ϵ�д�
Сѧ�̲�ȫ��ϵ�д� Сѧ��ѧ������ѿڶ���ϵ�д�
Сѧ��ѧ������ѿڶ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���ͼ��ʾ��10mLpH=3��A��Һ�м�ˮϡ�͵�V1mL��ҺpH�ı仯������˵������ȷ����

A. ��V1=100����ϡ��ǰA��Ũ��һ����0.001mol/L
B. a��ˮ�ĵ���̶�һ��С��b��
C. ��AΪNH4Cl��HCl�Ļ����Һ����V1һ������100
D. ��AΪNH4Cl��NH3��H2O�Ļ����Һ������Һ��c(NH4+)>c(Cl-)>c(H+)>c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Կ��淴Ӧ4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)������������ȷ����
4NO(g)+6H2O(g)������������ȷ����
A. ����λʱ��������xmolNO��ͬʱ������xmolNH3����Ӧ�ﵽƽ��״̬
B. �ﵽ��ѧƽ��ʱ4v��(O2)=5v��(NO)
C. �ﵽ��ѧƽ��ʱ�������������ݻ���������Ӧ���ʼ�С���淴Ӧ��������
D. ��ѧ��Ӧ���ʹ�ϵ��2v��(NH3)=3v��(H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��3A(g)+ B(g) ![]() C(s)+ 4D(g) ��H��0 ��ͼ��a��b ��ʾһ�������£�D�����������ʱ��t�ı仯�������Ҫʹ����b ��Ϊ���� a���ɲ�ȡ�Ĵ�ʩ�ǣ� ��
C(s)+ 4D(g) ��H��0 ��ͼ��a��b ��ʾһ�������£�D�����������ʱ��t�ı仯�������Ҫʹ����b ��Ϊ���� a���ɲ�ȡ�Ĵ�ʩ�ǣ� ��
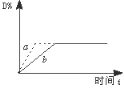
A. ���� B ��Ũ��
B. ���߷�Ӧ�¶�
C. ����Ӧ���������
D. �������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����
��1��ijԪ��ԭ�ӵ�������ΪA������������Xn��������x�����ӣ�w������Ԫ�ص�ԭ�Ӻ������ӵ����ʵ���Ϊmol
��2����K2SO4��KCl�Ļ����Һ�У�K+�����ʵ���Ũ��Ϊ1.2mol/L��SO42�������ʵ���Ũ��Ϊ0.4mol/L�������Һ��Cl�������ʵ���Ũ��Ϊ��
��3��д������������ˮ�ķ�Ӧ����ʽ �� �������뻹ԭ�������ʵ�����Ϊ ��
��4����1L1molL��1NaCl��Һ��ȡ��200mL��Һ��ȡ������Һ��NaCl�����ʵ���Ũ����molL��1 �� ȡ������Һ��NaCl�����ʵ�����mol��������g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڴ��������
A. ������������B. ����C. Һ��D. ���Ҳ�����ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڵ����ʵ�˵����ȷ����
A. ��������
B. ˮ�����Ϊ��֬����
C. �����м���(NH4)2SO4����ְ�ɫ����
D. ��ֵ��ߵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ˪������Ǧ����һ����ҩ�����нⶾ������̵��֮��Ч�����Ʊ�����Ϊ������������Ͷ������Ǧ����ʹ֮�ܻ���������ϸɴ��������ȥ���ң����䣬���ô���Ǧ�ᾧ�����辫�ƣ��ɽ��ᾧ����ͬ�����ķ������δ����������߲�ϸ������Һ���䣬���ô���Ǧ˪���Ʊ�������û���漰�IJ����ǣ�������
A. ��ȡB. �ܽ�C. ����D. �ؽ�Ʒ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪʵ����ijŨ�����Լ�ƿ��ǩ�ϵ��й����ݣ��Ը��ݱ�ǩ�ϵ��й����ݻش��������⣺ 
��1����Ũ������HCl�����ʵ���Ũ��ΪmolL��1 ��
��2��ijѧ����������Ũ���������ˮ����500mL ���ʵ���Ũ��Ϊ0.400molL��1��ϡ���ᣮ
�ٸ�ѧ����Ҫ��ȡmL ����Ũ����������ƣ�
�������ƹ����У�����ʵ����������Ƶ�ϡ��������ʵ���Ũ��ƫС����
A������Ͳ��ȡŨ��������ӹ۲찼Һ��
B�����ݺ���ҡ�ȡ����ã�����Һ���½����ټ�����������ˮ
C��������ƿ��ϴ����δ�����������ˮ���������Ƶ���ҺŨ�Ƚ�
D������ʱ���۾�����
E��δ��ȴ�����¾�ע������ƿ����
�����ƹ����У����õ����������ձ�������������Ͳ��� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com