
【题目】证明某溶液中只含Fe2+而不含Fe3+的实验方法是( )
A.只滴加KSCN溶液
B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C.先滴加氯水,再滴加KSCN溶液后显红色
D.滴加NaOH溶液,产生白色沉淀
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白。荧光素是发光物质的基质, 5-羧基荧光素与5-羧基二乙酸荧光素在碱性条件下有强烈的绿色荧光,它们广泛应用于荧光分析等。( )

![]()
下列说法不正确的是 ( )
A. 5-FAM转变为5-CFDA属于取代反应
B. 5-FAM的分子式为C21H12O7
C. 5-FAM和5-CFDA 各1mol分别与足量NaOH溶液反应,5-CFDA消耗的NaOH 物质的量多
D. 实验室鉴别5-FAM与5-CFDA可用NaHCO3 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中粒子的物质的量浓度关系正确的是
A. 0.1 mol·L-1 Na2CO3与0.l mol·L-1 NaHCO3溶液等体积混合:2/3 c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3)
B. 0.1 mol·L-1 Na2C2O4与0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
C. 0.1 mol·L-1 CH3COONa与0.l mol·L-1 HCl 溶液等体积混合:c(Na+) = c(Cl-) > c(OH-) > c(CH3COO-)
D. 0.l mol·L-1 NH4Cl与0.l mol·L-1氨水等体积混合(pH > 7): c(NH3·H2O) > c(NH4+) > c(Cl-) > c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是大气主要污染物,可采用强氧化剂氧化脱除、热分解等方法处理氮氧化物。
Ⅰ.已知:

(1)写出反应1的离子方程式___________。
(2)在反应2中,NO2-的初始浓度为0.1mol·L-1,反应为NO2-+S2O82-+2OH-![]() NO3-+2SO42-+H2O。不同温度下,达到平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如下图所示。
NO3-+2SO42-+H2O。不同温度下,达到平衡时NO2-的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如下图所示。

①比较a、b点的反应速率:va逆_______vb正(填或“>”“<”或“=”)
②随着温度的升高,该反应的化学平衡常数K______(填“增大”、“不变”或“减小”)。
③已知90℃时,Kw=3.6×10-13,若b点对应的pH为12,则该温度下K=_____(保留一位小数)。
(3)工业电解硫酸钠和硫酸的混合液制备过硫酸钠(Na2S2O8),阳极的电极反应式为_______。
Ⅱ.N2O在金粉表面发生热分解:2N2O(g)=2N2(g)+O2(g) ΔH。
回答下列问题:
(4)已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(1) ΔH1
4NH3(g)+3O2(g)=2N2(g)+6H2O(1) ΔH2
ΔH=_____。(含ΔH1、ΔH2的代数式)
(5)某温度下,测得c(N2O)随时间t变化关系如图所示。
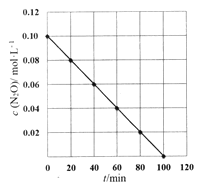
己知瞬时反应速率v与c(N2O)的关系为v=kcn(N2O)(k是反应速率常数),则k=________,n=_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1 mol A、2 mol B,此时甲、乙的容积均为2 L(连通管体积忽略不计)。在T℃时,两容器中均发生下述反应:A(g)+2B(g)![]() 2C(g)+3D(g) △H < 0。达平衡时,乙的体积为2.6 L,下列说法正确的是
2C(g)+3D(g) △H < 0。达平衡时,乙的体积为2.6 L,下列说法正确的是
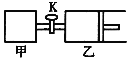
A. 甲中反应的平衡常数小于乙
B. 若打开活塞K,达平衡时乙容器的体积为3.2 L
C. 当乙中A与B的体积分数之比为1:2时,反应达到平衡状态
D. 平衡时甲容器中A的物质的量小于0.55 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂不仅是营养物质和主要食物,也是一种重要的工业原料。下面是以油脂为主要原料获得部分产品的合成路线:

己知:①G (C10H10O4)分子中的官能团处于对位;
②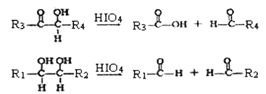
(R1、R2、R3与R4可能是氢、烃基或其他基团)
回答下列问题:
(1)下列关于油脂的说法正确的是____。(填标号)
a.油脂包括植物油和脂肪,属于酯类
b.天然油脂是混合甘油酯组成的混合物,无固定的熔点和沸点
c.油脂属天然高分子化合物,许多油脂兼有烯烃的化学性质
d.硬化油又叫人造脂肪,便于储存和运输,但容易被空气氧化变质
(2)G中官能团的名称为______,反应①的反应类型为_________。
(3)用系统命名法写出F的名称___________。
(4)在酸催化下物质的量的B与苯酚反应生成一种线型结构高分子的化学方程式为______________________。
(5)二元取代芳香化合物H是G的同分异构体,H满足下列条件:
①能发生银镜反应
②酸性条件下水解产物物质的量之比为2:1
③不与NaHCO3溶液反应。
则符合上述条件的H共有______种(不考虑立体结构,不包含G本身)。其中核磁共振氢谱为五组峰的结构简式为________(写出一种即可)。
(6)写出从HOCH2CH2OH![]() HCOOCH2CH2OOCH的合成路线(无机试剂任选,合成路线参照题中的书写形式)______________。
HCOOCH2CH2OOCH的合成路线(无机试剂任选,合成路线参照题中的书写形式)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 22.4L CO2与足量Na2O2完全反应,转移电子数为2NA
B. 6.4 g 由S2、S4、S8组成的混合物含硫原子数为0.2NA
C. 1mol/L的NaCl溶液中Cl—的数目为NA
D. 标况下,22.4L NO和11.2L O2,混合后气体分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧氧化技术被广泛用于饮用水的处理,但也会产生易致癌的 BrO3-。
(1)取含 Br -的水样,向其中投加一定量的 H2O2 ,再经 O3氧化后,水中溴酸盐(BrO3-)的含量如图所示

①投加过氧化氢,其目的是___。
②未投加过氧化氢,臭氧投加量在 0~1.0 mg·L-1时,BrO3 -的浓度为 0 的可能原因是___ 。
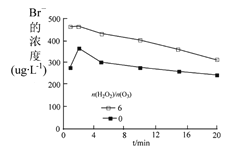
(2)科研小组在控制其他条件一定时,研究 n(H2O2)/n(O3) 对水样中 Br-浓度的影响,结果如图。在相同时刻,投加 H2O2 的反应中 Br-的浓度高于未投加 H2O2 的,其可能原因是反应过程中生成的HBrO 被 H2O2 还原所致,该反应的化学方程式为___ 。
(3)BrO3 -能被活性炭有效去除,其去除机理分为两步,第一步是___;第二步是 BrO3 -被活性炭还原为Br-。反应方程式(未配平)如下:
≡C+BrO3-→ BrO- + ≡CO2 ①
≡C+BrO-→ Br - + ≡CO2 ②
反应的总方程式为:2BrO3- + 3 ≡C = 2Br- + 3 ≡CO2。其中≡C 代表活性炭表面,≡CO2代表活性炭表面氧化物。则反应①与反应②中参加反应的≡C 物质的量之比为___ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com