
【题目】将![]() 绿矾
绿矾![]() 样品进行加热,其热重曲线
样品进行加热,其热重曲线![]() 样品质量随温度变化的曲线
样品质量随温度变化的曲线![]() 如图所示。下列说法正确的是
如图所示。下列说法正确的是![]()
![]()

A.![]() 时,获得的固体产物为
时,获得的固体产物为![]()
B.![]() 时,反应的化学方程式为
时,反应的化学方程式为![]()
C.Q段获得的固态产物具有磁性
D.Q段获得的气态产物只有![]()
【答案】A
【解析】
8.34g FeSO47H2O样品物质的量=![]() =0.03mol,其中m(H2O)=0.03mol×7×18g/mol=3.78g,如晶体全部失去结晶水,固体的质量应为8.34g-3.78g=4.56g,可知在加热到373℃之前,晶体失去部分结晶水,结合质量的变化可确定在不同温度时加热后固体的化学式,加热至633℃时,固体的质量为2.40g,其中n(Fe)=n(FeSO47H2O)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,则固体中m(O)=2.40g-1.68g=0.72g,n(O)=
=0.03mol,其中m(H2O)=0.03mol×7×18g/mol=3.78g,如晶体全部失去结晶水,固体的质量应为8.34g-3.78g=4.56g,可知在加热到373℃之前,晶体失去部分结晶水,结合质量的变化可确定在不同温度时加热后固体的化学式,加热至633℃时,固体的质量为2.40g,其中n(Fe)=n(FeSO47H2O)=0.03mol,m(Fe)=0.03mol×56g/mol=1.68g,则固体中m(O)=2.40g-1.68g=0.72g,n(O)=![]() =0.045mol,则n(Fe):n(O)=0.03mol:0.045mol=2:3,则固体物质Q的化学式为Fe2O3,以此解答该题。
=0.045mol,则n(Fe):n(O)=0.03mol:0.045mol=2:3,则固体物质Q的化学式为Fe2O3,以此解答该题。
A、样品的物质的量![]() ,
,![]() 时失去结晶水的物质的量
时失去结晶水的物质的量![]() ,则
,则![]() 失去
失去![]() 结晶水,
结晶水,![]() 时固态产物为
时固态产物为![]() ,A正确;
,A正确;
B、按照同样的计算方法可知,N段和P段的固态产物分别为![]() 和
和![]() ,则
,则![]() 时,反应的化学方程式为
时,反应的化学方程式为![]() ,B错误;
,B错误;
C、Q段固态产物中含有![]() ,则
,则![]() ,该物质为
,该物质为![]() ,C错误;
,C错误;
D、根据质量守恒定律以及C项的计算可知此时气态产物不可能只有![]() ,D错误。
,D错误。
故选A。


科目:高中化学 来源: 题型:
【题目】汽车发动机中生成NO的反应为:![]() ,
,![]() 时该反应的化学平衡常数
时该反应的化学平衡常数![]() 。在
。在![]() 下甲、乙、丙三个恒容密闭容器中,投入
下甲、乙、丙三个恒容密闭容器中,投入![]() 和
和![]() 模拟反应,起始浓度如下表所示。下列判断不正确的是.
模拟反应,起始浓度如下表所示。下列判断不正确的是.
起始浓度 | 甲 | 乙 | 丙 |
|
|
|
|
|
|
|
|
A.起始时,反应速率:丙![]() 甲
甲![]() 乙
乙
B.平衡时,![]() :甲
:甲![]() 丙
丙![]() 乙
乙
C.平衡时,![]() 的转化率:甲
的转化率:甲![]() 乙
乙
D.平衡时,甲中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冬青油是一种无色液体,某实验小组利用如图所示的装置制备冬青油。化学反应原理和实验装置如下所示:
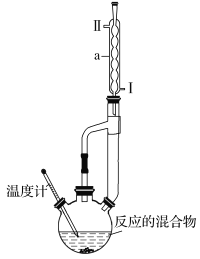
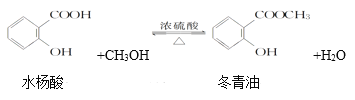
产物的有关数据如表所示:
相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 溶解性 | |
冬青油 | 152 | 1.180 | 222.2 | 微溶于水 |
实验步骤如下所示:
①向三颈瓶中加入6.9g(0.05mol)水杨酸和24g(0.75mol)甲醇,再小心地加入6mL浓硫酸,摇匀。
②加入2粒沸石(或碎瓷片),装上仪器a,在石棉网上保持温度在85~95℃,回流1.5h。
③反应完毕,将烧瓶冷却,加入50mL蒸馏水,然后转移至分液漏斗,弃去水层,将有机层再倒入分液漏斗中,依次用50mL5%碳酸氢钠溶液和30 mL水洗涤。
④将产物移至干燥的锥形瓶中,加入0.5g无水氯化钙。
⑤最后将粗产品进行蒸馏,收集221~224℃的馏分,其质量为6.8g。
请回答下列问题:
(1)本实验中浓硫酸的作用是___。
(2)装置中仪器a的名称是___,进水口为___(填“Ⅰ”或“Ⅱ”)。温度计的适宜规格为___(填代号)。
①50℃ ②100℃ ③300℃
(3)用碳酸氢钠溶液洗涤的目的是___;用水洗涤时,产品在___(填“上”或“下”)层。
(4)加入无水氯化钙的目的是____。
(5)本次实验中冬青油的产率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定镁带在空气中完全燃烧后所得固体产物![]() 假设只含MgO、
假设只含MgO、![]() 的组成,某同学称取
的组成,某同学称取![]() 固体进行如下实验
固体进行如下实验![]() 室温
室温![]() :
:
![]()
已知:![]()
下列说法错误的是
A.![]() 不能存在于水中
不能存在于水中
B.固体中![]()
C.溶液X中存在![]()
D.![]() 等于
等于![]() 时,溶液X中的
时,溶液X中的![]() 恰好沉淀完全
恰好沉淀完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金投入到1mol/L盐酸里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图A所示。下列说法中不正确的是( )

A.a的取值范围为0≤a<50
B.![]() 的最大值为2.5
的最大值为2.5
C.若将关系图改为B图时,则a的取值范围为80<a<90
D.若将关系图改为C图时,则a的取值范围为75<a<90
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某![]() 溶液中,通入
溶液中,通入![]() 标准状况下
标准状况下![]() 的
的![]() ,测得溶液中
,测得溶液中![]() 。反应过程中溶液的体积变化忽略不计,则下列说法中正确的是
。反应过程中溶液的体积变化忽略不计,则下列说法中正确的是
A.原溶液的浓度为![]()
B.反应后溶液中![]()
C.反应后溶液中![]()
D.原溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硼的结构如右图所示。已知晶体硼结构单元是由硼原子组成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个项点上各有1个B原子。下列有关说法不正确的是

A.每个硼分子含有12个硼原子
B.晶体硼是空间网状结构
C.晶体硼中键角是60°
D.每个硼分子含有30个硼硼单键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍及其化合物的应用正日益被重视。
(1)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的轨道表示式为__________。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有______(填字母)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
(3)氯化铍在气态时存在BeCl2分子(a)和二聚分子(BeCl2)2(b),固态时则具有如下图所示的链状结构(c)。

①a属于________(填“极性”或“非极性”)分子。
②二聚分子(BeCl2)2中Be原子的杂化方式相同,且所有原子都在同一平面上。b 的结构式为__________(标出配位键)。
(4)BeO立方晶胞如下图所示,若BeO晶体的密度为d g·cm-3,则晶胞参数a=______ nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是最简单的烃,是一种重要的化工原料。
(1)以甲烷为原料,有两种方法合成甲醇:
方法Ι:①CH4(g)+![]() O2(g)
O2(g)![]() CO(g)+2H2(g) △H1=-35.4kJ/mol
CO(g)+2H2(g) △H1=-35.4kJ/mol
②CO(g)+2H2(g)![]() CH3OH(g) △H2 =-90.1kJ/mol
CH3OH(g) △H2 =-90.1kJ/mol
方法Ⅱ: ③2CH4(g)+O2(g)![]() 2CH3OH(g) △H3 =______kJ/mol
2CH3OH(g) △H3 =______kJ/mol
(2)在密闭容器中充入2molCH4 (g) 和1molO2 (g),在不同条件下反应:2CH4(g)+O2(g)![]() 2CH3OH(g)。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示。
2CH3OH(g)。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示。

①P1时升高温度,n(CH3OH)_______________(填“增大”、“减小”或“不变”);
②E、F、N点对应的化学反应速率由大到小的顺序为____________(用V(E)、V(F)、V(N)表示);
③下列能提高CH4平衡转化率的措施是_______________(填序号)
a.选择高效催化剂 b.增大![]() 投料比 c.及时分离产物
投料比 c.及时分离产物
④若F点n (CH3OH)=1mol,总压强为2.5MPa,则T0时F点用分压强代替浓度表示的平衡常数Kp=_____________________ ;
(3)使用新型催化剂进行反应2CH4(g)+O2 (g)![]() 2CH3OH(g)。随温度升高CH3OH的产率如图所示。
2CH3OH(g)。随温度升高CH3OH的产率如图所示。

①CH3OH的产率在T1至T2时很快增大的原因是______________;
②T2后CH3OH产率降低的原因可能是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com