
����Ŀ������������ɫ��״Һ��е�Ϊ38.4�棬������ˮ�������ڶ����л��ܼ�����NaBr���塢C2H5OH��ŨH2SO4��ˮΪԭ�ϣ��Է�Ӧ��Ļ��Һ�ȿ����ձ��еõ��ֲ�Ʒ�������飩����Ӧװ����ͼ������ȥ�гֺͼ���װ�ã�����Ӧԭ������NaBr+H2SO4��Ũ��=NaHSO4+HBr����CH3CH2OH+HBr![]() CH3CH2Br+H2O�������й�˵����ȷ���ǣ� ��
CH3CH2Br+H2O�������й�˵����ȷ���ǣ� ��
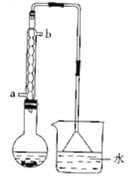
A.��ƿ���Լ�������Ⱥ�˳��Ũ���ᡢˮ���廯�ơ��Ҵ�
B.���� װ�ô��浹��©��װ��
װ�ô��浹��©��װ��
C.����ˮ��b�ڽ�a�ڳ�
D.�ֲ�Ʒ��ˮϴ�ӡ������ᾧ�õ�������������
���𰸡�B
��������
A��Ũ��������ˮ�ų��������ȣ����Ũ����Ӧ����ˮ�У������������ܹ���ʱɢ����ȥ������ƿ���ȼ�Ũ������ˮ���ײ���Һ��ɽ�������Σ�գ�A����
B����Ӧ�漰��HBr�ӷ��Ҽ�������ˮ������©���������Ƿ�������Ҳ���� װ�ô��棬B��ȷ��
װ�ô��棬B��ȷ��
C��Ϊ�ﵽ�Ϻõ�����Ч��������ˮӦa�ڽ�b�ڳ���C����
D�������鳣����Ϊ������ˮ��Һ�壬��Һ���ɷ��룬�������ᾧ�ò��������飬D����
��ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ĵ�ͳ���ǽ������ϡ�
(1)��ͨ�����ֳ�Ϊ�Ʋ�������д��������ͨ���������з�����Ӧ�Ļ�ѧ����ʽ��_____________��_______________��
(2)ʵ��������ʢ�ż����Լ����Լ�ƿ����ĥ�ڲ�������ԭ����(�����ӷ���ʽ��ʾ)��______________�������Լ�ƿ����ʢ��������ԭ����(�û�ѧ����ʽ��ʾ)��______________��
(3)��һ�����ⲣ��Ϊ�ز�������������ϵ����С�������ۻ��������ܻ�ѧҩƷ����ʴ������������һ��Ļ�ѧ����������ʯӢɰ�����Լء���ʯ��Ϊԭ�ϣ����Ƽز�����������Ϊ75��28��37(�ٶ���Щԭ�ϲ�������)���������������ʽ��ʾ�üز��������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ���ǣ� ��
A. NaHS��Һˮ��ķ���ʽΪ��HS��+H2O![]() S2��+H3O+
S2��+H3O+
B. ��H218O��Ͷ��Na2O2���壺2H218O+2Na2O2�T4Na++4OH��+18O2��
C. ��100 mL 2 mol/L FeBr2��Һ��ͨ��4.48 L����������£�����ַ�Ӧ��2Fe2++2Br��+2Cl2��2Fe3++Br2+4Cl��
D. �ö��Ե缫��ⱥ���Ȼ�����Һ��2Cl��+2H+![]() H2��+Cl2��
H2��+Cl2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ɫ�����ĩ����FeCl3��CaCO3��Na2SO4��KCl��Ba(NO3)2�еļ���������ɣ�ȡ��Ʒ��������ʵ�飨�������й����У��ܷ�Ӧ������֮��ķ�Ӧǡ����ȫ����

��1����������÷��뷽������___��Ҫ�Ӳ�������á���ɫ��Һ������ȡ�ܼ������÷��뷽������___��
��2��д��ʵ������з�����ѧ��Ӧ�����ӷ���ʽ��___����___��
��3�������ĩ��һ�������ڵ������ǣ��ѧʽ����ͬ��___������ȷ���Ƿ���ڵ�������___��
��4���������ĩ���ܵ���������±������Բ�������Ҳ�����ٲ��䣩��___
��� | ��ѧʽ |
�� | |
�� | |
��5�����һ��ʵ�飬��һ��ȷ����������ɣ�����ʵ�����������ͽ��ۡ�___
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���к͵ζ��Ǹ��л�ѧ��Ҫ�Ķ���ʵ�顣��ش��������⣺
��1���ñ�����ζ�δ֪Ũ�ȵ�NaOH��Һ�������������ɲⶨ���ƫ�ߵ���____(��ѡ����ĸ)��
A.�ζ��յ����ʱ�����ӵζ��̶ܿ�
B.ʢװNaOH��Һ����ƿ������ˮϴ����δ��NaOH��Һ��ϴ
C.��ʽ�ζ���������ˮϴ����δ�ñ�������ϴ
D.�ζ�ǰ���ζ��ܼ��������ݣ��ζ���������ʧ
��2��ȡ������Һ������ƿ�У���������ϡ���ᣬ��Ũ��Ϊ0.02mol��L��1�ĸ��������Һ�ζ���������Ӧ�����ӷ���ʽΪ��____��
��3��һ�ζ��������£�
�ζ����� | ����Һ���(mL) | ��KMnO4��Һ���(mL) | |
�ζ�ǰ���� | �ζ������ | ||
��һ�� | 25.00 | 0.50 | 20.40 |
�ڶ��� | 25.00 | 3.00 | 23.00 |
������ | 25.00 | 4.00 | 24.10 |
�ٵζ�ʱ���÷�Ӧ���ʿ�ʼʮ�ֻ�����һ��ʱ���ͻȻ�ӿ죬������Ϊ____�������ӣ��Ը÷�Ӧ���д����ã�KMnO4��ҺӦװ��____(����������������)ʽ�ζ����У��ζ��յ��������____��
�ڸò�����Һ�����ʵ���Ũ��Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������������![]() ��
��![]() ������ ������ ��
������ ������ ��![]() �����л�Ϊͬ���칹�����____________������ţ���������֮��Ĺ�ϵΪ_____________��
�����л�Ϊͬ���칹�����____________������ţ���������֮��Ĺ�ϵΪ_____________��
�ڢۢܢ��������ʰ����ǵķе��ɸߵ��͵�˳��������ȷ����_____________������ţ�
����ij��A���л���ѧ��ҵ�Ļ���ԭ�ϣ������������������һ�����ҵ�ʯ�ͻ�����չˮƽ��A��һ�������¿ɷ�����ͼ��ʾ��ת������ش��������⣺
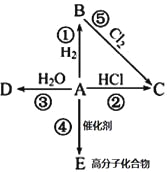
��1��д��A�ĵ���ʽ________��E�Ľṹ��ʽΪ______________
��2��д�����з�Ӧ��ѧ����ʽ����ע���ۢ���Ӧ����
�� _____________________________________________
�� _____________________ ����Ӧ����________��
�� _____________________ ����Ӧ����________��
��3����ȥB�л��е���������A�����õ��Լ�Ϊ___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ע����ˮ����֤������������ش��������⣺
(1)����ˮ�е�![]() �����ཡ�������Σ����Ϊ�˽�������ˮ��
�����ཡ�������Σ����Ϊ�˽�������ˮ��![]() ��Ũ�ȣ������ڼ��������������۽�
��Ũ�ȣ������ڼ��������������۽�![]() ��ԭΪN2���仯ѧ����ʽΪ�� 10Al��6NaNO3��4NaOH��10NaAlO2��3N2����2H2O��
��ԭΪN2���仯ѧ����ʽΪ�� 10Al��6NaNO3��4NaOH��10NaAlO2��3N2����2H2O��
������Ӧ�У�_________Ԫ�صĻ��ϼ����ߣ����Ԫ�ص�ԭ��_______(�����õ�������ʧȥ��)���ӡ�����1mol N2����ʱ����Ӧ��ת�Ƶ��ӵ���ĿΪ____________��
(2)���ֹ�������ˮ������ɱ����Ϊ���ƴ��ģ��Ⱦ�Լ�����������Ч����֮һ��Ư���dz��õ�����������ҵ�Ͻ�����ͨ��ʯ���� [Ca(OH)2]��ȡƯ�ۣ���ѧ����ʽΪ��__________________��
(3)KA1(SO4)212H2O������Ϊ��������������ˮ����_____________(��ѧʽ)�����������ʣ��Ӷ��ﵽ��ˮ���á���������Һ�μ�ϡ����������Һ�������������ӷ���ʽ�ͱ�Ҫ����������������_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ�ص�����Ϣ�����
Ԫ�ش��� | Q | R | X | Z |
����Ϣ | ���ӣ� | ���ʷ��ӣ�R2 | ���ӣ�X3+ | һ��ԭ�ӣ� |
��֪Q��R��X���ڵ������ڣ�R2���³�ѹ��Ϊ����ɫ���塣
���������գ�
��1��Q�����ڱ���λ���ǣ�___��������Q2Z�ĵ���ʽΪ___��
��2��Q��R��X��ԭ�Ӱ뾶�ɴ�С��˳��Ϊ___����Ԫ�ط��ű�ʾ����Q��R��X��Z�н�������ǿ����___����Ԫ�ط��ű�ʾ����
��3��Q��X���ߵ�����������Ӧ��ˮ����֮�䷢����Ӧ�ķ���ʽΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����ͬŨ�ȵ�NaOH��Һ�ֱ�ζ�20.00mLŨ�Ⱦ�Ϊ0.1mol��L-1�������ᣨHA��HB��HC����Һ���ζ���������ͼ��ʾ�������ж�����ȷ����
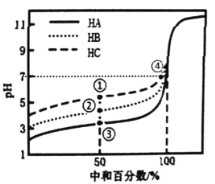
A.���кͰٷ�����50%ʱ��![]()
B.�ζ����ٵ�ʱ����Һ�У�![]()
C.���кͰٷ�����100%ʱ�����ĵ�NaOH��Һ���![]()
D.�ٺ͢���ʾ��Һ�ж��У�![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com