
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.查看答案和解析>>
科目:高中化学 来源: 题型:
 铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成.
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成.
| ||
| 冰晶石 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 反应A(g)+B(g)═C(g)+D(g)过程中的能量变化如图所示,回答下列问题:
反应A(g)+B(g)═C(g)+D(g)过程中的能量变化如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| N2 |
| △ |
| H2O |
| H2O |
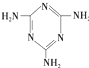 (三聚氰胺)
(三聚氰胺) ),三聚氰酸分子中N原子采取
),三聚氰酸分子中N原子采取 是电石的晶胞示意图,则一个晶胞中含有
是电石的晶胞示意图,则一个晶胞中含有查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com