
| A、气体A为SO2和H2的混合物 |
| B、反应中共消耗Zn 65g |
| C、气体A中SO2和H2的体积比为1:4 |
| D、反应中共转移电子2mol |
| 22.4L |
| 22,4L/mol |
| 22.4L |
| 22,4L/mol |
|


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
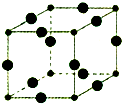 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电能是二次能源 |
| B、水力是二次能源 |
| C、天然气是二次能源 |
| D、焦炉气是一次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯能发生加成反应,乙烷不能发生加成反应 |
| B、甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色 |
| C、苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 |
| D、发生硝化反应时,苯需要加热,甲苯在常温下就能进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多 |
| B、两种溶液的物质的量浓度不相同 |
| C、分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-) |
| D、它们分别与足量CaCO3反应时,放出的CO2一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、干冰熔化时分子内共价键会发生断裂 |
| B、分子晶体中的每个分子内一定含有共价键 |
| C、烯烃比烷烃化学性质活泼是由于烷烃中只有σ键而烯烃含有π键 |
| D、C2H6是碳链为直线型的非极性分子,可推测C3H8也是碳链为直线型的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②①④③ | B、②④①③ |
| C、①②④③ | D、③①④② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1MgCl2溶液:K+、H+、S2-、Cl- |
| B、0.1mol?L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- |
| C、0.1mol?L-1的NaOH溶液:K+、Na+、SO42-、CO32- |
| D、1.0mol?L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com