
| A、它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多 |
| B、两种溶液的物质的量浓度不相同 |
| C、分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-) |
| D、它们分别与足量CaCO3反应时,放出的CO2一样多 |


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
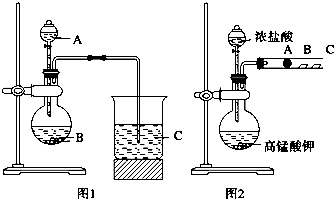
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体A为SO2和H2的混合物 |
| B、反应中共消耗Zn 65g |
| C、气体A中SO2和H2的体积比为1:4 |
| D、反应中共转移电子2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性:HClO4>H3PO4>H2SO4 |
| B、碱性:KOH>NaOH>Mg(OH)2 |
| C、离子半径:O2->F->Cl->Na+ |
| D、氢化物稳定性:H2S>HF>H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.6molNO |
| B、0.3molNO2和0.3molNO |
| C、0.2molNO2和0.1molN2O4 |
| D、0.1molNO和0.2molNO2和0.05molN2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B、把几滴FeCl3饱和溶液滴入25mL沸水中制备Fe(OH)3胶体 |
| C、过滤可以除掉粗盐中可溶于水的杂质 |
| D、碘易溶于有机溶剂,可用CCl4萃取碘水中的碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、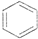 +HNO3 +HNO3
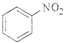 +H2O +H2O | |||
B、CH2=CH2+Br2→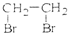 | |||
C、CH3CH2OH+CH3COOH
| |||
D、CH4+Cl2
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com