
����Ŀ��ʮ�Ŵ��лع���ʮ�˴����������й�ȡ�õľ�ɾͣ������δ����չ�ĺ�ΰ�ձꡣ��ѧ�ڿ�ѧ����������������ᷢչ��������ΰ���ס�
��1��������������ᷢչ�����ʻ��������Ͽ�ѧ�ķ�չ�벻����ѧ��
���մɡ�ˮ�����ͨ������������������IJ��ϣ���������__________��
A.�������� B.���ǽ������� C.�л��߷��Ӳ���
�����������ϣ������������ǿ�Ⱥ����Ե�����ֲļ����µ�Ԫ�������������½���������������___________��
A.������һ��������DZ������ѹ�������
B.������һ��ս�����ٷ������г��ܳ����µIJ���
C.������һ��DZͧ��������ײ�Ľ��ͽ�β��β��IJ���
���ѺϽ��������-10 �ɻ�����������ɴ�������Ŀƣ���������ȣ��ѺϽ��ǿ��________�������������� ���� ������ȷ�����������н�ǿ�Ŀ���ʴ������
��ʯīϩ����Ϊ���ڽ����������²���֮��������ѧ������Ԥ��ʯīϩ�������ı�21�������� ʯīϩ�������³�ǿ���ԣ����ö�Ӧ����ѡ�����
A.������ B.������ C.�����
�п�Ժɽ��ú̿��ѧ�о����о�Ӧ��ʯīϩ��Ϊ�����ģ�����ɵ�·��ɢ�ȴ�ƣ���Ӧ����ʯīϩ
��_________��ѡ����ţ���ͬ�����п�Ժ�Ϻ��������о������о���Ա����ϸС�Ĺ�״ʯīϩ���������һ��ǿ�ȱ�ͬ�����ĸֲ�Ҫ��207������ĭ״���ϣ����ֲ���Ӧ����ʯīϩ��_________�� �п�Ժ������ɫ���ܼ����о�Ժ���п�Ժ�������ϼ����빤���о���������ȫ������3 ��ʯīϩ�ֻ����ÿ��ֻ��������������Ƶ�ʯīϩ����������أ�10 ���ӿɳ���6000mAh����ͼ���Ӧ����ʯīϩ��______��
��2�����λ�����Ⱦ��������̬�����ѳ�Ϊȫ��ʶ��
�����д�ʩ�����ڸ��ƻ�����������___________��
A.��ֹ�ո�¶����գ�Ӧ�����ں�ʹ����Ȼ���ý���
B.�����������ع�ϸ���࣬Ӧ���������Է���Ϊ������
C.�й����Ƴ�һ�������黯������һ�������������ͺ�ʹ��������10%��ʯ�ĺ�����
��������ˮ�����ܽ���_________���� �����ԣ�������ָpH__________�Ľ�ˮ������ȼ�պ���ú������������ˮ���䵽���棬pH��ʱ��䳤��������С�����û�ѧ����ʽ������ԭ��______________��
��ʯ�ҷ�������������ʯ��ʯ�õ�����ʯ��Ϊ�����������������������е�SO2��Ӧ������̶������������������ϡ�����Ӧ�Ļ�ѧ����ʽΪ___________________��
����̬ũҵ�漰ũ�ҷʵ��ۺ����ã�ij�ַ��Ͼ����͵õ�һ�ֺ����顢CO2�������Ļ�����壬������ͨ��ʢ�к���CuO��ĩ��Ӳ�ʲ����ܣ���ʹ������ȫת��ͬʱ�õ��Ϻ�ɫ���壬������Ӧ�Ļ�ѧ����ʽΪ_________________��
���𰸡� B B �� B C A C CO2 <5.6 2H2SO3+O2=2H2SO4 2CaO+2SO2+O2![]() 2CaSO4 (CaO+SO2
2CaSO4 (CaO+SO2![]() CaSO3��2CaSO3+O2
CaSO3��2CaSO3+O2![]() 2CaSO4 ) CH4+4CuO
2CaSO4 ) CH4+4CuO![]() 4Cu+CO2+2H2O
4Cu+CO2+2H2O
����������1�����մɡ�ˮ�����ͨ������������������IJ��ϣ������������ǽ������ϣ���ѡB�������������ϣ������������ǿ�Ⱥ�����������ֲļ�������Ԫ�������������½���������������������һ��ս�����ٷ������г��ܳ����µIJ��ϣ���ѡB���ۺϽ��Ӳ��һ��ȴ������ĸߣ����ѺϽ��������-10�ɻ�����������ɴ�������Ŀƣ���������ȣ��ѺϽ��ǿ�ȸߣ����н�ǿ�Ŀ���ʴ��������ʯīϩ����Ϊ���ڽ����������²���֮��������ѧ������Ԥ��ʯīϩ�������ı�21�������� ʯīϩ�������³�ǿ����-�����ԣ���ѡB���п�Ժɽ��ú̿��ѧ�о����о�Ӧ��ʯīϩ��Ϊ�����ģ�����ɵ�·��ɢ�ȴ�ƣ���Ӧ����ʯīϩ�Ļ�е���ԣ���ѡC���п�Ժ�Ϻ��������о������о���Ա����ϸС�Ĺ�״ʯīϩ���������һ��ǿ�ȱ�ͬ�����ĸֲ�Ҫ��207������ĭ״���ϣ����ֲ���Ӧ����ʯīϩ�ĵ����ԣ���ѡA���п�Ժ������ɫ���ܼ����о�Ժ���п�Ժ�������ϼ����빤���о���������ȫ������3��ʯīϩ�ֻ����ÿ��ֻ��������������Ƶ�ʯīϩ����������أ�10���ӿɳ���6000mAh����ͼ���Ӧ����ʯīϩ�ĵ����ԣ���ѡB����2���� A. ¶����սոѶ����塢��������������ͨ��ȫ�������Ʋ�����Σ�����������ں�ʹ����Ȼ���ý�����ֱ����ȾˮԴ��ѡ��A����B. �����������ײ������fӢ������������к����ʣ�ѡ��B����C.�й����Ƴ�һ�������黯������һ�������������ͺ�ʹ��������10%��ʯ�ĺ�������ѡ��C��ȷ����ѡC����������ˮ�����ܽ���CO2���������ԣ�������ָpH<5.6�Ľ�ˮ������ȼ�պ���ú������������ˮ���䵽���棬pH��ʱ��䳤��������С����ѧ����ʽΪ��2H2SO3+O2=2H2SO4����ʯ�ҷ�������������ʯ��ʯ�õ�����ʯ��Ϊ�����������������������е�SO2��Ӧ������̶������������������ϡ�����Ӧ�Ļ�ѧ����ʽΪ2CaO+2SO2+O2![]() 2CaSO4 (CaO+SO2
2CaSO4 (CaO+SO2![]() CaSO3��2CaSO3+O2
CaSO3��2CaSO3+O2![]() 2CaSO4 )������̬ũҵ�漰ũ�ҷʵ��ۺ����ã�ij�ַ��Ͼ����͵õ�һ�ֺ����顢CO2�������Ļ�����壬������ͨ��ʢ�к���CuO��ĩ��Ӳ�ʲ����ܣ���ʹ������ȫת��ͬʱ�õ��Ϻ�ɫ����ͭ��������Ӧ�Ļ�ѧ����ʽΪCH4+4CuO
2CaSO4 )������̬ũҵ�漰ũ�ҷʵ��ۺ����ã�ij�ַ��Ͼ����͵õ�һ�ֺ����顢CO2�������Ļ�����壬������ͨ��ʢ�к���CuO��ĩ��Ӳ�ʲ����ܣ���ʹ������ȫת��ͬʱ�õ��Ϻ�ɫ����ͭ��������Ӧ�Ļ�ѧ����ʽΪCH4+4CuO![]() 4Cu+CO2+2H2O��
4Cu+CO2+2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ����£��������м��ַ�Ӧ����16H++10Zһ+2XO ![]() =2X2++5Z2+8H2O ��2A2++B2=2A3++2Bһ ��2Bһ+Z2=B2+2Z����������Ӧ���ж����н����д�����ǣ� ��
=2X2++5Z2+8H2O ��2A2++B2=2A3++2Bһ ��2Bһ+Z2=B2+2Z����������Ӧ���ж����н����д�����ǣ� ��
A.������ǿ����˳��Ϊ��XO ![]() ��Z2��B2��A3+
��Z2��B2��A3+
B.Z2�ڢ١��۷�Ӧ��Ϊ��ԭ��
C.��Һ�пɷ�����Z2+2A2+=2A3++2Zһ
D.X2ʮ��XO ![]() ����������
����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1905��¹���ѧ�ҹ��������˺ϳɰ��ķ���������˻����1918���ŵ������ѧ�������ĺϳɲ�������˵���������ʳ��������µļ������������⣬�ڹ�������Դ���Ṥҵ����Ҳ�й㷺��;��
����Ϊԭ�ϣ��ϳ����صķ�Ӧԭ��Ϊ��
2NH3��g��+CO2��g���TCO��NH2��2��l��+H2O��g����H=a kJ/mol��
Ϊ�о�ƽ��ʱCO2��ת�����뷴Ӧ��Ͷ�ϱȣ� ![]() �����¶ȵĹ�ϵ���о�С����10L�����ܱ������н���ģ�ⷴӦ���������ͼ�������߷ֱ��ʾ�ڲ�ͬͶ�ϱ�ʱ��CO2��ת�������¶�֮��Ĺ�ϵ����
�����¶ȵĹ�ϵ���о�С����10L�����ܱ������н���ģ�ⷴӦ���������ͼ�������߷ֱ��ʾ�ڲ�ͬͶ�ϱ�ʱ��CO2��ת�������¶�֮��Ĺ�ϵ����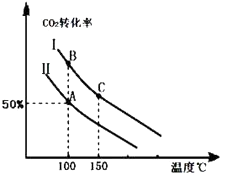
��1��a0 ���������������������� ��
��2����Ͷ�ϱȣ����������������
����n��CO2����ʼ=10mol�����ߢ��Ͷ�ϱ�Ϊ0.4����100�������·�����Ӧ����ƽ����A�㣬��A������ʼѹǿ��Ϊ ��
��A��ƽ�ⳣ����B��ƽ�ⳣ����Ĺ�ϵ��KAKB�������������=������B������Ӧ������C������Ӧ���ʼ�Ĺ�ϵΪ��v��B��v��C���������������=������
��3���������ߢ��Ͷ�ϱ�Ͷ�ϣ�������ʵ����ѹ�����������5L����ͼ�л�����Ӧ��ƽ��ʱ�Ķ�����̼��ת�������¶�֮��Ĺ�ϵ���ߣ�
��4��Ϊ���CO2ת���ʿ��Բ�ȡ�Ĵ�ʩ�� ��
a��ʹ�ô��� b����ʱ����ϵ�з��������CO��NH2��2c������ϵ�е�ˮ����Һ������
���������ڹ�ҵ���������ᣬ��β���е�NO2���ð�ˮ������������泥�25��ʱ����10molNH4NO3����ˮ����Һ�����ԣ������Һ�еμ�1LijŨ�ȵİ�ˮ����Һ�����ԣ���μӰ�ˮ�Ĺ�����ˮ�ĵ���ƽ�⽫����������������� �ƶ�����������Һ��NH3H2O�����ʵ���Ϊmol����25��ʱ��NH3H2O�ĵ���ƽ�ⳣ��Kb=2��10��5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������岻����ɴ�����Ⱦ����
A. �������� B. ���� C. һ����̼ D. һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ã���X,Yѡ�ò�ͬ����ʱ���ɽ����ԭ���㷺Ӧ���ڹ�ҵ����������˵������ȷ���ǣ� �� 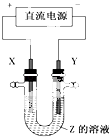
A.�ȼҵ�У�X,Y��Ϊʯī��X�����ܵõ���������
B.ͭ�ľ����У�X�Ǵ�ͭ��Y�Ǵ�ͭ��Z��CuSO4
C.��ƹ�ҵ�У�X�Ǵ��ƽ�����Y�ǶƲ����
D.��ӵ����������������У�Y�Ǵ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���������������أ������й�˵����ȷ����
A.�辧����а뵼�����ܣ���������ȡ���ά
B.�����������Ư��ֽ��
C.����������ڿ�ʴ����
D.������Ư�۳���������ˮ�ľ�����ɱ�����������ߵ�����ԭ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤����������ֵ������������ȷ���ǣ� ��
A.0.1molL��1��NaCl��Һ��Cl������ĿΪ0.1NA
B.16g O3����������ԭ����ΪNA
C.22.4L H2�к��е���ԭ����һ��Ϊ2NA
D.1mol Cl2������Ľ����Ƴ�ַ�Ӧ��ת�Ƶĵ�����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ���ǣ� ��
A.�Ȼ�����Һ�м��������ˮ��Al3++4NH?H2O�TAlO2��+4NH4++2H2O
B.���ˮ�еμ�FeCl3��Һ�Ʊ�Fe��OH��3���壺Fe3++3H2O ![]() Fe��OH��3+3H+
Fe��OH��3+3H+
C.̼������ڴ��CaCO3+2H+�TCa2++CO2��+H2O
D.�Ȼ�������Һ��ͨ��������2Fe2++Cl2�T2Fe3++2Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��HCl+NH3=NH4Cl�����壩��ͼ��ʾ����ȥװ���еIJ���Ƭ��ʹ���������ַ�Ӧ��������������Ϊװ�����������ã������¶Ȼָ���ԭ���¶ȣ�����˵����ȷ���ǣ� �� 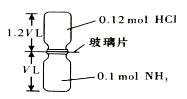
A.��Ӧ��ƿ��ѹǿ�Ƿ�Ӧǰ�� ![]()
B.װ������Ԫ�ص�������Ϊ0.42 g
C.������ķ�����ĿΪ0.1 NA
D.��Ӧ��������������ƿ�����ֿ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com