


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢铁的腐蚀过程中,析氢腐蚀与吸氧腐蚀不可能同时发生 |
| B、反应NH4Cl(s)=NH3(g)+HCl(g)在室温下不能自发进行,则该反应的△H>0 |
| C、由于Ksp(BaSO4)<Ksp(BaCO3),因此BaSO4沉淀不可能转化为BaCO3沉淀 |
| D、25℃时,0.1 mol?L-1CH3COOH溶液加水稀释后,c(OH-)/c(CH3COOH)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②⑤ | B、①③⑤ |
| C、②③④ | D、①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、C(s)+
| ||
| B、2H2(g)+O2(g)═2H2O(g)△H=+571.6kJ/mol | ||
| C、C2H4(g)+3O2(g)═2CO2(g)+2H2O(g)△H=-1411.0kJ/mol-1 | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
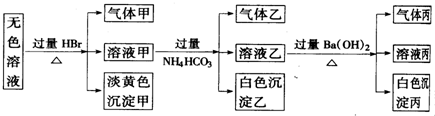
查看答案和解析>>
科目:高中化学 来源: 题型:
A、按系统命名法,化合物 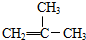 的名称为:2-甲基丙烯 的名称为:2-甲基丙烯 |
| B、具有手性异构的两个物质,性质上有较大的差别 |
C、如图所示的化合物是苯的同系物 |
| D、烯烃和甲苯都可以使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com