
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的( )

A.原子半径Z<M
B.X的最简单气态氢化物的热稳定性比Z的小
C.Y的最高价氧化物对应水化物的酸性比X的弱
D.Z位于元素周期表中第二周期第ⅥA族
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量,Y型管中一侧放镁,一侧放稀硫酸,倾斜Y型管,将稀硫酸全部倒入另一侧,反应开始。
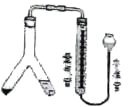
(1)在Y型管中添加试剂时,要确保________过量。
(2)反应前后都要调整量气管和水准管液面相平,从而保证_____相等。若读数时,量气管中的液面低于水准管的液面,实验测得H2的体积将______。(填“偏大”“偏小”或“不变”)
(3)若镁的质量为m g,c mol/L硫酸溶液V mL,反应后收集到的氢气体积为a mL(已折算为标准状况下),则镁的相对原子质量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为__________,其中氮的化合价为______。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的离子方程式____________。
(3)联氨和N2O4可作为火箭推进剂,其反应的产物均无污染。其氧化产物和还原产物之比为 _______。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似。联氨与硫酸形成的酸式盐的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝土矿的主要成分为Al2O3·xH2O,还含有Fe2O3和SiO2杂质。称取17.5g铝土矿样品,加入200mL1.65mol/L稀H2SO4,恰好完全反应,过滤得到滤渣0.3g,然后在滤液中加入足量NaOH溶液,得到沉淀2.14g。(提示:SiO2杂不与稀硫酸反应)
(1)写出本题涉及到的任意两个反应的化学方程式或离子方程式___。
(2)该样品中,Fe2O3的物质的量___。
(3)铝土矿样品中Al2O3的质量___。
(4)试计算样品中Al2O3·xH2O的x值___。(要求计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年10月中国药学家屠呦呦因发现青蒿素(一种用于治疗疟疾的药物)而获得诺贝尔生理医学奖。青蒿素(C15H22O5)的结构如图所示。请回答下列问题:
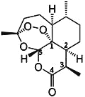
(1)组成青蒿素的三种元素电负性由小到大排序是_____,在基态O原子中,核外存在_____对自旋相反的电子。
(2)下列关于青蒿素的说法正确的是_____(填序号)。
a.青蒿素中既存在极性键又存在非极性键
b.在青蒿素分子中,所有碳原子均采取sp3杂化
c.图中数字标识的五个碳原子均只以σ键与其它原子成键
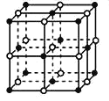
(3)在确定青蒿素结构的过程中,可采用NaBH4作为还原剂,其制备方法为:4NaH+B(OCH3)→3NaBH4+3CH3ONa
①NaH为_____晶体,如图是NaH晶胞结构,则NaH晶体的配位数是_____,若晶胞棱长为a,则Na原子最小核间距为_____。
②B(OCH3)3中B采用的杂化类型是_____。写出两个与B(OCH3)3具有相同空间构型的分子或离子_____。
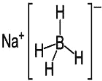
③NaBH4结构如图所示,结构中存在的化学键类型有_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图表法、图象法是常用的科学研究方法。
(1)短周期某主族元素M的电离能情况如图1所示。则M元素位于周期表的第_____族。
(2)图2是研究部分主族元素氢化物的沸点变化规律的图象,折线c可以表达出第_____族元素气态氢化物的沸点变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线(a和b),你认为正确的是折线_____(填a或b)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
A.Cu2(OH)2CO3(s)![]() CuCl2(aq)
CuCl2(aq)![]() Cu(s)
Cu(s)
B.NaCl(aq)![]() NaHCO3(s)
NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)
C.Fe(s)![]() Fe2O3(s)
Fe2O3(s)![]() FeCl3(aq)
FeCl3(aq)
D.SiO2(s)![]() SiCl4(l)
SiCl4(l)![]() Si(s)
Si(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
氮原子可以形成 σ 键、π 键、大 π 键和配位键,成键的多样性使其形成了多种具有独特组成的物质。回答下 列问题:
(1)第一电离能:氮______氧(填“大于”或“小于”),基态氮原子价电子排布图不是![]() ,是因 为该排布方式违背了__________。
,是因 为该排布方式违背了__________。
(2)肼(H2NNH2)分子中孤电子对与 σ 键的数目之比为______,肼的相对分子质量与乙烯接近,但沸点远高于乙烯的原因是______。
( 3)硝酸的结构可表 示 为 ![]() ,硝酸与水分子可 形 成一水合二硝酸结晶 水 合物 (2HNO3 H2O) , 水分子以三个氢键与两个硝酸分子结合,请写出一水合二硝酸的结构式______(氢键用“…”表示)。
,硝酸与水分子可 形 成一水合二硝酸结晶 水 合物 (2HNO3 H2O) , 水分子以三个氢键与两个硝酸分子结合,请写出一水合二硝酸的结构式______(氢键用“…”表示)。
(4)正硝酸钠(Na3NO4)为白色晶体,是一种重要的化工原料。
①Na3NO4 阴离子的空间构型为______,其中心原子杂化方式为______。
②分别写出一种与 Na3NO4 的阴离子互为等电子体的阴离子和分子______(填化学式)。
③在 573 K 条件下,实验室中用 NaNO3 和 Na2O 在银皿中反应制得 Na3NO4,Na2O 的立方晶胞如图所 示。

图中“●”表示______(填“Na+”或“O2”),距离“●”最近且等距离的“○”有______个,Na2O 晶胞的参数为 a pm,则晶胞密度为_____gcm3。(列出计算式即可,NA 为阿伏加德罗常数的值)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com