
【题目】某铝土矿的主要成分为Al2O3·xH2O,还含有Fe2O3和SiO2杂质。称取17.5g铝土矿样品,加入200mL1.65mol/L稀H2SO4,恰好完全反应,过滤得到滤渣0.3g,然后在滤液中加入足量NaOH溶液,得到沉淀2.14g。(提示:SiO2杂不与稀硫酸反应)
(1)写出本题涉及到的任意两个反应的化学方程式或离子方程式___。
(2)该样品中,Fe2O3的物质的量___。
(3)铝土矿样品中Al2O3的质量___。
(4)试计算样品中Al2O3·xH2O的x值___。(要求计算过程)
【答案】Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O等 0.01mol 10.2g 3
【解析】
氧化铝、氧化铁与硫酸反应,而二氧化硅不反应,故0.3g为二氧化硅的质量,滤液中加入足量的氢氧化钠,铝离子转化为偏铝酸盐,故得到沉淀2.14g为氢氧化铁的质量。
(1)涉及反应有:氧化铝与硫酸反应生成硫酸铝与水,氧化铁与硫酸反应生成硫酸铁与水,硫酸铁与氢氧化钠反应生成氢氧化铁与硫酸钠.硫酸铝与足量氢氧化钠反应生成偏铝酸钠、硫酸钠与水,任意两个反应离子方程式为:Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O,
答:任意两个离子方程式为:Fe3++3OH-=Fe(OH)3↓,Al3++4OH-=AlO2-+2H2O等;
(2)根据Fe元素守恒,n(Fe2O3)=![]() n[Fe(OH)3]=
n[Fe(OH)3]=![]() ×
×![]() =0.01mol,
=0.01mol,
答:该样品中,Fe2O3的物质的量为0.01mol;
(3)根据硫酸根守恒:3n[Al2(SO4)3]+3n[Fe2(SO4)3]=n(H2SO4),即3n[Al2(SO4)3]+3×0.01mol=0.2L×1.65mol/L,则n[Al2(SO4)3]=0.1mol,根据Al元素守恒,n(Al2O3)=n[Al2(SO4)3]=0.1mol,故m(Al2O3)=0.1mol×102g/mol=10.2g,
答:铝土矿样品中Al2O3的质量为10.2g;
(4)样品中水的质量为17.5g-0.3g-10.2g-0.01mol×160g/mol=5.4g,物质的量为![]() =0.3mol,则0.1mol:0.3mol=1:x,故x=3,
=0.3mol,则0.1mol:0.3mol=1:x,故x=3,
答:样品中Al2O3.xH2O的x值为3。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氨是化肥工业和基础有机化工的主要原料。
(1)合成氨反应过程中有关物质的化学键键能数据如下表所示:
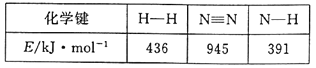
请写出该合成氨反应的热化学方程式___。
(2)一定温度下,合成氨反应在a、b两种条件下分别达到平衡,H2的浓度随时间的变化如图所示。
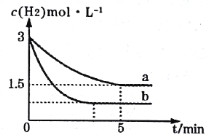
①a条件下,0~5min内的平均反应速率v(N2)=___mol·L-1·min-1。
②相对a而言,b可能改变的条件是___。
(3)某化学兴趣小组向一恒温密闭容器中充入4molN2和12molH2模拟合成氨反应,平衡混合物中氨气的体积分数与总压强(p)的关系如图所示。
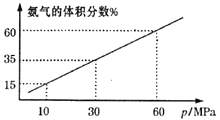
若体系在60MPa下达到平衡。H2的平衡分压为___MPa。(分压=总压×物质的量分数);列式计算此时的平衡常数Kp=___。(用平衡分压代替平衡浓度计算,结果保留2位有效数字)
(4)下列图示中能表示合成氨反应在恒温、恒容密闭容器中在t1时刻已经达到平衡状态的是___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是
4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是
A.向容器中充入4 mol NH3和5 mol O2进行反应,达到平衡时放出的热量为905.9 kJ。
B.平衡时v正(O2)=v逆(NO)。
C.平衡后降低压强,混合气体平均摩尔质量增大。
D.平衡后升高温度,混合气体中NO含量降低。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一反应:2A+B![]() 2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有 a、b、c三点,如图所示,则下列描述正确的是
2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有 a、b、c三点,如图所示,则下列描述正确的是
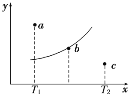
A.该反应是放热反应
B.b点时混合气体的平均摩尔质量不再变化
C.T1温度下若由a点达到平衡,可以采取增大压强的方法
D.c点:v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaCl(aq)![]() Cl2(g)
Cl2(g)![]() FeCl2(s)
FeCl2(s)
B. MgCl2(aq)![]() Mg(OH)2(s)
Mg(OH)2(s)![]() MgO (s)
MgO (s)
C. S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
D. N2(g)![]() NH3(g)
NH3(g)![]() Na2CO3(s)
Na2CO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的( )

A.原子半径Z<M
B.X的最简单气态氢化物的热稳定性比Z的小
C.Y的最高价氧化物对应水化物的酸性比X的弱
D.Z位于元素周期表中第二周期第ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料 PET 聚酯树脂和 PMMA 的合成路线如下:
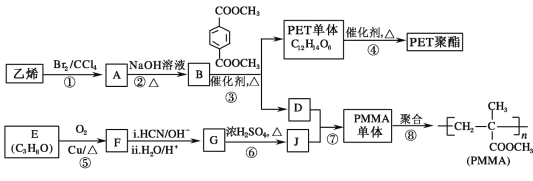
已知:Ⅰ.RCOOR′+R″18OH RCO18OR″+R′OH(R、R′、R″代表烃基)
RCO18OR″+R′OH(R、R′、R″代表烃基)
II.  (R、R′代表烃基)
(R、R′代表烃基)
(1)①的反应类型是_____________。
(2)②的化学方程式为____________。
(3)PMMA 单体的官能团名称是_____、_____。
(4)F 的核磁共振氢谱显示只有一组峰,⑤的化学方程式为:_________。
(5)G 的结构简式为______________。
(6)下列说法正确的是__________(填字母序号)。
a.⑦为酯化反应
b.B 和 D 互为同系物
c.D 的沸点比同碳原子数的烷烃高
d.1mol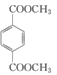 与足量 NaOH 溶液反应时,最多消耗 4 mol NaOH
与足量 NaOH 溶液反应时,最多消耗 4 mol NaOH
(7)J 的某种同分异构体与 J 具有相同官能团,且为顺式结构,其结构简式是:______。
(8)写出由 PET 单体制备 PET 聚酯并生成 B 的化学方程式:__________。
(9)写出⑦的化学方程式为:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学为了验证明矾的化学组成,进行了如下实验:
(1)把明矾的水溶液分别加入两试管中,用焰色反应,透过蓝色钴玻璃观察火焰为紫色,说明含有________________;
(2)在其中一个试管中,加入过量氨水,产生大量白色沉淀,将沉淀分为两部分,分别加入过量的盐酸和氢氧化钠,沉淀均消夫,说明明矾溶液中含____________(离子符号),写出白色沉淀和氢氧化钠溶液反应的离子方程式________________________________________________;
(3)在另一个试管中,加入盐酸酸化过的氯化钡溶液,产生白色沉淀,说明明矾溶液中含____________________________ (离子符号);
(4)明矾水溶液的pH值________7,其原因是________________________________ (离子方程式);明矾可以用作净水剂,其原因是____________________________________,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com