
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是
4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是
A.向容器中充入4 mol NH3和5 mol O2进行反应,达到平衡时放出的热量为905.9 kJ。
B.平衡时v正(O2)=v逆(NO)。
C.平衡后降低压强,混合气体平均摩尔质量增大。
D.平衡后升高温度,混合气体中NO含量降低。
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图和有关数据如下:
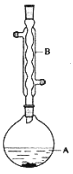
![]() +H2O
+H2O
相对原子质量 | 密度/(g.cm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
实验步骤:
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。回答下列问题:
(1)装置B的名称是:___。
(2)该反应中浓硫酸的作用___,若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式___。
(3)如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作___。
(4)在洗涤操作中,第一次水洗的主要目的是:___;第二次水洗的主要目的是:___。
(5)本实验中加入过量乙酸的目的是:___。
(6)在蒸馏操作中,仪器选择及安装都正确的是:___(填标号)
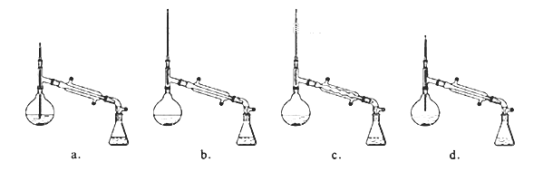
(7)本实验的产率是___。
A.30℅ B.40℅ C.50℅ D.60℅
(8)在进行蒸馏操作时,若从130℃开始收集馏分,产率偏___(填高或者低)原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量,Y型管中一侧放镁,一侧放稀硫酸,倾斜Y型管,将稀硫酸全部倒入另一侧,反应开始。
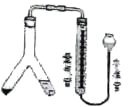
(1)在Y型管中添加试剂时,要确保________过量。
(2)反应前后都要调整量气管和水准管液面相平,从而保证_____相等。若读数时,量气管中的液面低于水准管的液面,实验测得H2的体积将______。(填“偏大”“偏小”或“不变”)
(3)若镁的质量为m g,c mol/L硫酸溶液V mL,反应后收集到的氢气体积为a mL(已折算为标准状况下),则镁的相对原子质量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化氢常用于制备碘的化合物和用作有机反应的还原剂。碘化氢不稳定,易分解,碘化氢极易溶于水,其水溶液称为氢碘酸,氢碘酸是强酸,有较强的还原性。
(1)氢碘酸若在空气中长期放置,溶液会变成黄色,其原因是___(用化学方程式来表示)。
(2)实验室中常用干燥的红磷和碘相互接触,加少量水微热,即可生成碘化氢和亚磷酸(H3PO3),该反应的化学方程式为___。
(3)氢气和碘蒸气能直接反应生成碘化氢,H2(g)+I2(g)![]() 2HI(g) ΔH<0。T℃时,向1L恒容密闭容器中充入0.2molH2和0.2molI2(g),5min时反应达到平衡,H2、I2(g)和HI的物质的量浓度(c)随时间(t)变化的曲线如图l所示:
2HI(g) ΔH<0。T℃时,向1L恒容密闭容器中充入0.2molH2和0.2molI2(g),5min时反应达到平衡,H2、I2(g)和HI的物质的量浓度(c)随时间(t)变化的曲线如图l所示:
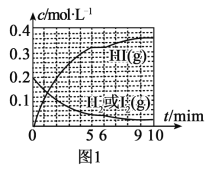
①0~5min内,以HI表示的该反应速率v(HI)=___。
②T℃时,该反应的平衡常数K=___。
③6min时,改变的外界条件为___。
④10min时,保持其他条件不变,再向容器中充入0.1molH2、0.1molI2(g)、0.2molHI(g),12min时达到新平衡。在图2中画出10~12min,H2和HI的浓度变化曲线___(曲线上标明H2和HI);0~5min和0~2min时间段,H2的转化率分别用α1、α2表示,则αl___α2(填“>”、“<”或“=”)。
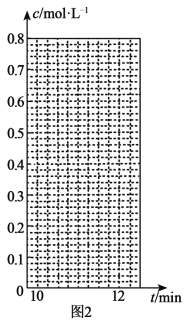
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-===CaCO3↓+H2O
B. 酸性高锰酸钾溶液与稀草酸反应:5C2O42-+2MnO4-+16H+===2Mn2++10CO2+8H2O
C. AgCl的悬浊液中滴加Na2S溶液:2AgCl+S2-===Ag2S+2Cl-
D. NH4HCO3溶液加入过量NaOH溶液加热:NH4++OH-===NH3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )

A. 若A是铁,则E可能为稀硝酸
B. 若A是CuO,E是碳,则B为CO
C. 若A是NaOH溶液,E是CO2,则B为NaHCO3
D. 若A是AlCl3溶液,E可能是氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为__________,其中氮的化合价为______。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的离子方程式____________。
(3)联氨和N2O4可作为火箭推进剂,其反应的产物均无污染。其氧化产物和还原产物之比为 _______。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似。联氨与硫酸形成的酸式盐的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝土矿的主要成分为Al2O3·xH2O,还含有Fe2O3和SiO2杂质。称取17.5g铝土矿样品,加入200mL1.65mol/L稀H2SO4,恰好完全反应,过滤得到滤渣0.3g,然后在滤液中加入足量NaOH溶液,得到沉淀2.14g。(提示:SiO2杂不与稀硫酸反应)
(1)写出本题涉及到的任意两个反应的化学方程式或离子方程式___。
(2)该样品中,Fe2O3的物质的量___。
(3)铝土矿样品中Al2O3的质量___。
(4)试计算样品中Al2O3·xH2O的x值___。(要求计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
A.Cu2(OH)2CO3(s)![]() CuCl2(aq)
CuCl2(aq)![]() Cu(s)
Cu(s)
B.NaCl(aq)![]() NaHCO3(s)
NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)
C.Fe(s)![]() Fe2O3(s)
Fe2O3(s)![]() FeCl3(aq)
FeCl3(aq)
D.SiO2(s)![]() SiCl4(l)
SiCl4(l)![]() Si(s)
Si(s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com