
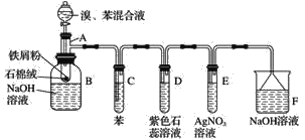
【题目】苯和液溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。填写下列空白:
(1)写出A中主要反应的化学方程式:___________
(2)试管C中苯的作用是______________。反应开始后,观察试管D和试管E,看到的现象分别为D____________E____________。
(3)仪器B中的NaOH溶液的作用是____________,可观察到的现象是________。
(4)在上述整套装置中,具有防倒吸作用的装置有__________(填字母)。
【答案】![]() +Br2
+Br2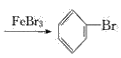 +HBr 除去HBr气体中混有的溴蒸气 紫色石蕊溶液慢慢变红,并在导管口有白雾产生 出现浅黄色沉淀 除去溶于溴苯中混有的溴,便于观察溴苯的颜色 在溶液底部有无色油状液体 DEF
+HBr 除去HBr气体中混有的溴蒸气 紫色石蕊溶液慢慢变红,并在导管口有白雾产生 出现浅黄色沉淀 除去溶于溴苯中混有的溴,便于观察溴苯的颜色 在溶液底部有无色油状液体 DEF
【解析】
由实验装置可知,A中苯与液溴发生取代反应生成溴苯、HBr,B中溴苯与NaOH溶液分层,且溴苯在下层,C中苯可除去挥发的溴,D中HBr使紫色石蕊变红,E中HBr与硝酸银反应生成淡黄色AgBr沉淀,F中NaOH可吸收尾气,倒扣的漏斗可防止倒吸,以此来解答。
(1)铁屑和溴发生反应:2Fe+3Br2=2FeBr3,生成的FeBr3作催化剂,使苯和液溴发生反应,化学方程式为![]()
(2)苯和液溴的反应是放热反应,且溴易挥发,挥发出来的溴蒸气对实验产生干扰,必须除去,可以利用溴易溶于有机物来除溴,因此试管C中苯的作用是除去HBr中混有的溴蒸气;HBr溶液显酸性,紫色石蕊溶液遇酸变红;AgNO3溶液与HBr发生反应:AgNO3+HBr=AgBr↓+HNO3,试管E中有淡黄色沉淀生成。
(3)纯净的溴苯为无色液体,因溶有溴而呈褐色,因此B中NaOH溶液的作用是除去溴苯中的溴,便于观察溴苯的颜色;溴苯是难溶于水、且密度比水的密度大的液体,故在溶液的底部可以观察到无色油状液体;
(4)在上述整套装置中,D、E中导管口均在液面上,F中有倒扣的漏斗刚好没入液面,则具有防倒吸的装置有D、E、F。


科目:高中化学 来源: 题型:
【题目】煤燃烧产生的烟气中含有SO2和NOx,用NaOH、NaClO、Ca(ClO)2等溶液作为吸收剂可同时对烟气进行脱硫、脱硝。
(1)下列关于吸收SO2过程发生的有关反应,用下列方程式表示:
①SO2(g)+2OH-(aq)=SO![]() (aq)+H2O(l) k1
(aq)+H2O(l) k1
②ClO-(aq)+SO![]() (aq)=SO
(aq)=SO![]() (aq)+Cl-(aq) k2
(aq)+Cl-(aq) k2
③CaSO4(s)=Ca2+(aq)+SO![]() (aq) k3
(aq) k3
k1、k2、k3分别表示反应①、②、③的化学平衡常数,则反应:SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的化学平衡常数K=___(用k1、k2、k3表示)。
(2)标准状况下,把SO2通入11.2mL水中制得饱和溶液,测得其pH=0.74。已知:标准状况下SO2在水中的溶解度按体积比为1:67.2(即V(H2O):V(SO2)=1:67.2)。
①写出该溶液中存在的电离平衡___。
②已知饱和溶液中的SO2有![]() 与水反应生成H2SO3,求H2SO3的第一步电离平衡常数Ka1=___(已知lg1.8≈0.26,忽略第二步电离和溶液体积的变化,结果用科学计数法表示,保留2位有效数字)。
与水反应生成H2SO3,求H2SO3的第一步电离平衡常数Ka1=___(已知lg1.8≈0.26,忽略第二步电离和溶液体积的变化,结果用科学计数法表示,保留2位有效数字)。
(3)SO2的水溶液中存在歧化反应:3SO2+2H2O=2H2SO4+S↓,I-可作为该反应的催化剂,催化过程如下:
a:SO2+4I-+4H+=S↓+2I2+2H2Ob:I2+2H2O+SO2=SO42-+2I-+4H+
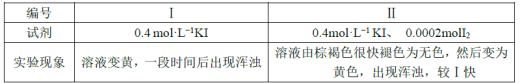
欲探究反应a和b的反应速率与歧化反应的速率的关系,设计实验如下:将18mLSO2的水溶液分别加入2mL下列试剂中,密闭放置,观察现象。(已知I2易溶于KI溶液,溶液呈棕褐色)
完成下列问题:
①由实验现象可得出反应a与反应b的速率:v(a)___v(b)(填“>”“﹤”或“=”)。
②测得反应3SO2+2H2O=2H2SO4+S↓在实验Ⅰ中,部分物质的物质的量的变化如图所示(设混合溶液的体积为两溶液的体积之和):则曲线N表示___(填物质的名称)的变化。该反应在实验Ⅰ条件下进行,15min时达到化学平衡状态,用SO2表示该反应前15min内的平均反应速率为___mol·L-1·min-1。

③下列叙述能说明3SO2(aq)+2H2O(l)=2H2SO4(aq)+S(s)反应已达到平衡状态的是____填字母)。
A.生成1.5molSO2的同时消耗1molH2SO4
B.反应过程中,溶液中的分子总数不再变化
C.恒温恒容时,混合溶液中硫酸的密度保持不变
D.绝热恒容时,反应的化学平衡常数不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.SiO2(s)+2C(s)=Si(s)+2CO(g)只能在高温下自发进行,则该反应ΔH<0
B.在外加电流的阴极保护法中,海上石油钢铁钻井平台与直流电源的负极相连
C.25℃时0.1mol·L-1CH3COONa溶液加水稀释后,溶液中![]() 的值减小
的值减小
D.“氧阴极还原法”制取H2O2的反应为2H2O+O2![]() 2H2O2。反应中每消耗2.24LO2(标准状况下),转移的电子数目为0.4×6.02×l023
2H2O2。反应中每消耗2.24LO2(标准状况下),转移的电子数目为0.4×6.02×l023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一块表面已部分被氧化、质量为0.77 g的钠放入10 g水中后,收集到氢气0.02 g。
(1)金属钠表面氧化钠的质量是________。
(2)所得溶液里溶质的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)根据下列变化关系:

请填空:
(1)A物质的名称_____ 。B溶液为____________.作用为_________________________
(2)写出④、⑥两步反应的化学方程式,在( )号中标明反应类型。
④ ________________________________________( )
⑥_______________________________________________( )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质混合后,有气体生成,最终无沉淀生成的是
①金属钠投入到FeCl3溶液中 ②金属镁投入到盐酸中 ③NaOH溶液和CuSO4溶液 ④金属铝投入NaOH溶液中
A.①②B.②④C.③④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g)![]() CO(g) +H2O(g)其平衡常数K和温度t的关系如下:
CO(g) +H2O(g)其平衡常数K和温度t的关系如下:
t℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)K的表达式为:___;
(2)该反应的正反应为__反应(“吸热”或“放热”);
(3)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时上述的反应中正、逆反应速率的关系式是__(填代号)。
A.υ(正)>υ(逆) B.υ(正)<υ(逆) C.υ(正)=υ(逆) D.无法判断
(4)在700℃通过压缩体积增大气体压强,则该反应中H2(g)的转化率___(“增大”、“减小”或“不变”);工业生产中,通过此方法使容器内气体压强增大以加快反应,却意外发现H2(g)的转化率也显著提高,请你从平衡原理解释其原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氧化钠和过氧化钠的叙述正确的是( )
A. 氧化钠比过氧化钠稳定
B. 都能与二氧化碳、水反应产生氧气
C. 所含氧元素的化合价都为-2价
D. 阴阳离子的个数比都为1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com