
【题目】下列说法中不正确的是( )
A.SiO2(s)+2C(s)=Si(s)+2CO(g)只能在高温下自发进行,则该反应ΔH<0
B.在外加电流的阴极保护法中,海上石油钢铁钻井平台与直流电源的负极相连
C.25℃时0.1mol·L-1CH3COONa溶液加水稀释后,溶液中![]() 的值减小
的值减小
D.“氧阴极还原法”制取H2O2的反应为2H2O+O2![]() 2H2O2。反应中每消耗2.24LO2(标准状况下),转移的电子数目为0.4×6.02×l023
2H2O2。反应中每消耗2.24LO2(标准状况下),转移的电子数目为0.4×6.02×l023
【答案】AD
【解析】
A.SiO2(s)+2C(s)=Si(s)+2CO(g)的ΔS>0,该反应只能在高温下自发进行,则该反应ΔH>0,A不正确;
B.在外加电流的阴极保护法中,为阻止钢铁失电子,海上石油钢铁钻井平台应作阴极,所以应与直流电源的负极相连,B正确;
C.25℃时0.1mol·L-1CH3COONa溶液加水稀释后,CH3COO 的水解程度变大,n(Na+)不变,而n(CH3COOH)增大,所以溶液中![]() =
=![]() 的值减小,C正确;
的值减小,C正确;
D.“氧阴极还原法”制取H2O2的反应为2H2O+O2![]() 2H2O2。2.24LO2(标准状况下)的物质的量为0.1mol,O元素由0价降低为-1价,所以转移的电子数目为0.2×6.02×l023,D不正确;
2H2O2。2.24LO2(标准状况下)的物质的量为0.1mol,O元素由0价降低为-1价,所以转移的电子数目为0.2×6.02×l023,D不正确;
故选AD。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
(4)以下收集NO气体的装置,合理的是________(填序号)。

(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理来解释的是
A.用排饱和食盐水的方法收集氯气
B.合成氨工业选择高温
C.开启啤酒瓶后,瓶中马上泛起大量泡沫
D.在Fe3++3SCN-![]() Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置正确且能达到实验目的的是( )
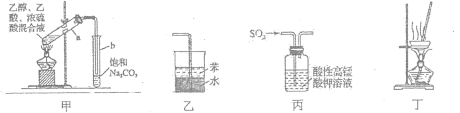
A.用图甲所示装置制取少量乙酸乙酯
B.用图乙所示装置吸收氨气防倒吸
C.用图丙所示装置验证SO2的漂白性
D.用图丁所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)

(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,采用了不同的实验方法(装置如图所示)。


(1)根据上图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号)____。
(2)图Ⅲ所示实验能够鉴别这两种物质,其反应的化学方程式为_______。
(3)图Ⅳ不仅能鉴别碳酸钠和碳酸氢钠,同时又能验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的物质为__________,实验过程中的现象为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,一定温度下发生2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为
4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A. 500 s内N2O5分解速率为2.96×10-3 mol/(L·s)
B. T1温度下的平衡常数为K1=125,1 000 s时转化率为50%
C. 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯和液溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。填写下列空白:
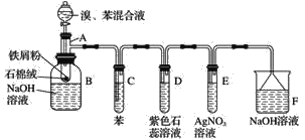
(1)写出A中主要反应的化学方程式:___________
(2)试管C中苯的作用是______________。反应开始后,观察试管D和试管E,看到的现象分别为D____________E____________。
(3)仪器B中的NaOH溶液的作用是____________,可观察到的现象是________。
(4)在上述整套装置中,具有防倒吸作用的装置有__________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚锡用途广泛,在无机工业中用作还原剂,在口腔护理行业中,二水氯化亚锡多用于防龋齿脱敏类牙膏中,以预防龋齿的发生。某研究小组制取二水氯化亚锡工艺流程如下:

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。
(1)四氯化锡暴露于空气中与空气中水分反应生成白烟,有强烈的刺激性气味,生成偏锡酸(H2SnO3),写出该反应的化学方程式______;
(2)将金属锡熔融,然后泼入冷水,激成锡花,其目的是______;
(3)在制备二水氯化亚锡时,温度对锡转化率的影响如图1所示,则该反应应控制的温度范围为______℃;

(4)反应原料中盐酸浓度对结晶率的影响如图2所示,则盐酸浓度应控制的范围为______,原因______。
(5)反应釜中发生反应的化学方程式为______;
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应)
①将该试样溶于盐酸,发生反应为Sn+2HCl=SnCl2+H2↑;
②加入过量FeCl3溶液
③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,则反应的离子方程式为______;
(7)取1.125g锡粉,经上述各步反应后,共用去0.1000mol/LK2Cr2O7溶液 30.00mL,锡粉中锡的质量分数为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com