
【题目】下列有关实验装置正确且能达到实验目的的是( )
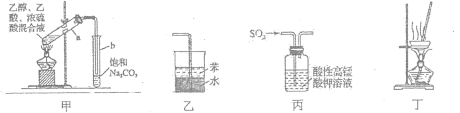
A.用图甲所示装置制取少量乙酸乙酯
B.用图乙所示装置吸收氨气防倒吸
C.用图丙所示装置验证SO2的漂白性
D.用图丁所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】常温常压时烯烃与氢气混合不反应,高温时反应很慢,但在适当的催化剂存在时可与氢气反应生成烷烃,一般认为加氢反应是在催化剂表面进行。反应过程的示意图如下:
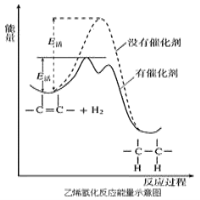
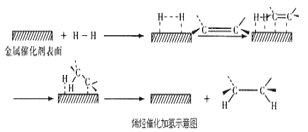
下列说法中正确的是( )
A.乙烯和H2生成乙烷的反应是放热反应
B.加入催化剂,可减小反应的热效应
C.催化剂能改变平衡转化率,不能改变化学平衡常数
D.催化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧产生的烟气中含有SO2和NOx,用NaOH、NaClO、Ca(ClO)2等溶液作为吸收剂可同时对烟气进行脱硫、脱硝。
(1)下列关于吸收SO2过程发生的有关反应,用下列方程式表示:
①SO2(g)+2OH-(aq)=SO![]() (aq)+H2O(l) k1
(aq)+H2O(l) k1
②ClO-(aq)+SO![]() (aq)=SO
(aq)=SO![]() (aq)+Cl-(aq) k2
(aq)+Cl-(aq) k2
③CaSO4(s)=Ca2+(aq)+SO![]() (aq) k3
(aq) k3
k1、k2、k3分别表示反应①、②、③的化学平衡常数,则反应:SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的化学平衡常数K=___(用k1、k2、k3表示)。
(2)标准状况下,把SO2通入11.2mL水中制得饱和溶液,测得其pH=0.74。已知:标准状况下SO2在水中的溶解度按体积比为1:67.2(即V(H2O):V(SO2)=1:67.2)。
①写出该溶液中存在的电离平衡___。
②已知饱和溶液中的SO2有![]() 与水反应生成H2SO3,求H2SO3的第一步电离平衡常数Ka1=___(已知lg1.8≈0.26,忽略第二步电离和溶液体积的变化,结果用科学计数法表示,保留2位有效数字)。
与水反应生成H2SO3,求H2SO3的第一步电离平衡常数Ka1=___(已知lg1.8≈0.26,忽略第二步电离和溶液体积的变化,结果用科学计数法表示,保留2位有效数字)。
(3)SO2的水溶液中存在歧化反应:3SO2+2H2O=2H2SO4+S↓,I-可作为该反应的催化剂,催化过程如下:
a:SO2+4I-+4H+=S↓+2I2+2H2Ob:I2+2H2O+SO2=SO42-+2I-+4H+
欲探究反应a和b的反应速率与歧化反应的速率的关系,设计实验如下:将18mLSO2的水溶液分别加入2mL下列试剂中,密闭放置,观察现象。(已知I2易溶于KI溶液,溶液呈棕褐色)
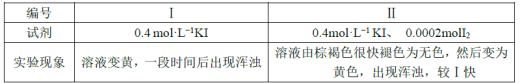
完成下列问题:
①由实验现象可得出反应a与反应b的速率:v(a)___v(b)(填“>”“﹤”或“=”)。
②测得反应3SO2+2H2O=2H2SO4+S↓在实验Ⅰ中,部分物质的物质的量的变化如图所示(设混合溶液的体积为两溶液的体积之和):则曲线N表示___(填物质的名称)的变化。该反应在实验Ⅰ条件下进行,15min时达到化学平衡状态,用SO2表示该反应前15min内的平均反应速率为___mol·L-1·min-1。

③下列叙述能说明3SO2(aq)+2H2O(l)=2H2SO4(aq)+S(s)反应已达到平衡状态的是____填字母)。
A.生成1.5molSO2的同时消耗1molH2SO4
B.反应过程中,溶液中的分子总数不再变化
C.恒温恒容时,混合溶液中硫酸的密度保持不变
D.绝热恒容时,反应的化学平衡常数不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研发出一种新型水溶液锂电池,采用复合膜包裹的金属锂作负极,锰酸锂(LiMn2O4)作正极,以0.5 mol/Li2SO4 水溶液作电解质溶液。电池充、放电时,LiMn2O4与Li2Mn2O4可以相互转化。下列有关该电池的说法正确的是

A. 该电池放电时,溶液中的SO42-向电极b移动
B. 该电池负极的电极反应式为:2Li+2H2O==2LiOH+H2↑
C. 电池充电时,外加直流电源的正极与电极a相连
D. 电池充电时,阳极的电极反应式为:Li2Mn2O4-e-==LiMn2O4 +Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如下:
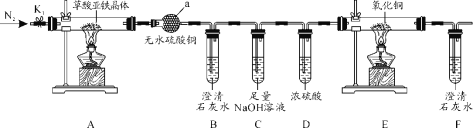
(1)仪器a的名称是______。
(2)从绿色化学考虑,该套装置存在的明显缺陷是_________。
(3)实验前先通入一段时间N2,其目的为__________。
(4)实验证明了气体产物中含有CO,依据的实验现象为_______。
(5)草酸亚铁晶体在空气易被氧化,检验草酸亚铁晶体是否氧化变质的实验操作是____。
(6)称取5.40g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如下图所示:
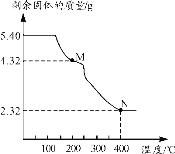
①上图中M点对应物质的化学式为_________。
②已知400℃时,剩余固体是铁的一种氧化物,试通过计算写出M→N发生反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W原子序数依次增大,且X、Z同主族,Y为金属元素,且Y的原子序数小于X和Z的最外层电子数之和,Z原子的最外层电子数与核外电子总数之比为3:8。下列说法正确的是( )
A.原子半径:r(W)>r(Y)>r(X)
B.X与Y组成的化合物中均不含共价键
C.X的简单气态氢化物的热稳定性比Z的强
D.W的氧化物对应的水化物酸性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.SiO2(s)+2C(s)=Si(s)+2CO(g)只能在高温下自发进行,则该反应ΔH<0
B.在外加电流的阴极保护法中,海上石油钢铁钻井平台与直流电源的负极相连
C.25℃时0.1mol·L-1CH3COONa溶液加水稀释后,溶液中![]() 的值减小
的值减小
D.“氧阴极还原法”制取H2O2的反应为2H2O+O2![]() 2H2O2。反应中每消耗2.24LO2(标准状况下),转移的电子数目为0.4×6.02×l023
2H2O2。反应中每消耗2.24LO2(标准状况下),转移的电子数目为0.4×6.02×l023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一块表面已部分被氧化、质量为0.77 g的钠放入10 g水中后,收集到氢气0.02 g。
(1)金属钠表面氧化钠的质量是________。
(2)所得溶液里溶质的质量分数是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com