
| A、石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | ||||
B、向沸水中滴加饱和的FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O(沸水)
| ||||
| C、氢氧化铜与稀硫酸反应:H++OH-═H2O | ||||
| D、碳酸氢钠溶液中加入盐酸:CO32-+2H+═CO2↑+H2O |
| ||
| ||


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
| A、2 p1>p2 |
| B、PCl5的分解率增大 |
| C、2 p1<p2 |
| D、PCl3%(体积含量)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,11.2L氧气所含的原子数为NA |
| B、1.8g的NH4+离子中含有的电子数为10NA |
| C、常温常压下,48g O3含有的氧原子数为3NA |
| D、2.4 g金属镁变为镁离子时失去的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.24 L NH3中含有6.02×1022个氮原子 |
| B、100 mL 1 mol/L 的Na2CO3溶液中含有6.02×1022个CO32- |
| C、将4 g NaOH溶于100 g蒸馏水,所得溶液物质的量浓度是0.1 mol/L |
| D、将7.8 g Na2O2放入足量的水中,反应时转移6.02×1022个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、15 g乙烷所含极性共价键的数目为3×6.02×1023 |
| B、标准状况下,11.2 L臭氧中含氧原子数为6.02×1023 |
| C、常温下,100 mL 0.1mol/L醋酸溶液中含醋酸分子为0.01×6.02×1023 |
| D、一定条件下,2 mol 二氧化硫和1 mol 氧气混合,反应时转移的电子数为4×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-+H2O?H3O++CO32- |
| B、NH3+H2O?NH4++OH- |
| C、CO32-+2H2O?H2CO3+2OH- |
| D、Al3++3H2O?Al(OH)3+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
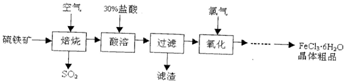
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com