
【题目】在一定条件下,在固定容积的密闭容器中,能表示反应X(气)+2Y(气)![]() 2Z(气)一定达到化学平衡状态的是( )
2Z(气)一定达到化学平衡状态的是( )
A.容器内压强不随时间改变
B. c(X).c(Y)2=c(Z)2
C.正反应生成Z的速率与逆反应生成X的速率相等
D.容器内混合气体的密度不随时间改变
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】与氢气完全加成后,不可能生成2,2,3-三甲基戊烷的烃是
A. (CH3)3 C—CH=CH2B. CH2=C(CH2CH3)C (CH3)3
C. HC≡CCH(CH3)C(CH3)3D. (CH3)3CC(CH3)=CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为 M 的气态化合物V L(标准状况),溶于m g 水中, 得到质量分数为 w、物质的量浓度为c mol/L、密度为ρg/mL 的溶液,下列说法正确的是( )
A. 溶液密度![]() B. 物质的量浓度
B. 物质的量浓度![]()
C. 溶液的质量分数![]() D. 相对分子质量
D. 相对分子质量![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)在700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2 > t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2 > t1):
反应时间/min | 0 | t1 | t2 |
n(CO)/mol | 1.20 | 0.80 | 0.80 |
①反应在t1min内的平均速率:v(H2)=____mol·L-1·min-1。
②t2时刻,该反应的正反应速率___逆反应速率(填“大于”、“小于”或“等于”)。
(2)氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。
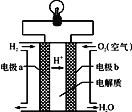
①该电池供电时,____能转化为____能。
②写出该电池供电时的总反应方程式________。
③电极b上发生______反应(“氧化”或“还原”)。
④在外电路中,电子流动的方向为________。
(3)镁铝合金(Mg17Al10)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al10+17H2=17MgH2+10Al。得到的混合物Y(17MgH2+10Al)在一定条件下可释放出氢气。
①镁铝合金的熔点比金属镁的熔点______。(填“高”或“低”)
②在6.0 mol·L-1 HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al10完全吸氢后得到的混合物Y与足量上述盐酸完全反应,释放出H2的物质的量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示(部分生成物和反应条件已略去)。D、F、G、H均为常见气体,其中D能使湿润的红色石蕊试纸变蓝,G呈黄绿色,H在空气中含量最高;C的摩尔质量为32g·mol-1;E为难溶性碱。
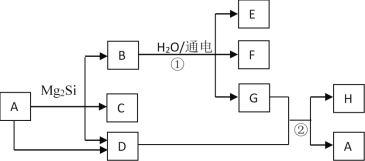
(1)C的化学式为_________;
(2)A的电子式为_________;
(3)写出反应①的离子方程式_______________;
(4)写出反应②的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2 min末该反应达到平衡,测得生成0.8 mol D, 0.4 mol C。下列判断不正确的是
xC(g)+2D(g)。2 min末该反应达到平衡,测得生成0.8 mol D, 0.4 mol C。下列判断不正确的是
A. x =1
B. 2 min时,A的浓度为0.9mol·L-1
C. 2 min内A的反应速率为0.3 mol·L-1·min-1
D. B的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,可以制备一系列物质(见下图),下列说法正确的是( )

A. NH4Cl和NaHCO3都是常用的化肥
B. NH4Cl、HNO3和Na2CO3受热时都易分解
C. NH3和NO2在一定条件下可发生氧化还原反应
D. 图中所涉及的盐类物质均可与Ca(OH)2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知95 ℃时水的离子积KW=1×10-12,25 ℃时KW=1×10-14,回答下列问题:
(1)95 ℃时水的电离常数K(95 ℃)________25 ℃时水的电离常数(填“>”、“=”或“<”)。
(2)95 ℃纯水中c(H+)________c(OH-)。(填“>”、“=”或“<”)
(3)95 ℃时向纯水中加入NaOH,c(OH-)=1×10-1 mol/L,此时pH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中A为淡黄色固体,B的阳离子与A相同(其他物质均略去).

根据以上关系,回答下列问题:
(1)A的电子式为__________.
(2)A投入FeCl2溶液中的反应为_______________(请用一个化学方程式表示)
(3)若A、B按物质的量之比1:1.5混合在密闭容器中加热充分反应后,排出气体,则剩余的固体为_____________________________(写化学式)
(4)氢能被视为21世纪最具发展潜力的清洁能源,试回答下列问题:
①与化石燃料相比,氢气作为燃料的优点是__________________(答两点)。
②施莱辛(Sehlesinger)等人提出可用NaBH4与水反应制氢气,写出NaBH4与水反应的化学方程式____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com