
【题目】某实验小组探究肉桂酸的制取:
I:主要试剂及物理性质
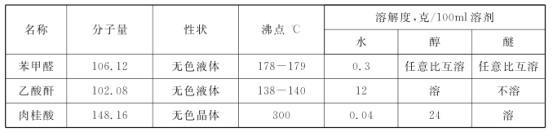
注意:乙酸酐溶于水发生水解反应
II :反应过程.
实验室制备肉桂酸的化学方程式为:  +(CH3CO2)O
+(CH3CO2)O![]()
![]() +CH3COOH
+CH3COOH
III::实验步骤及流程
①在250 mL三口烧瓶中(如图甲)放入3 ml(3. 15 g,0. 03 mol)新蒸馏过的苯甲醛、8 ml(8. 64g,0. 084 mol)新蒸馏过的乙酸酐,以及研细的4.2 g无水碳酸钾。采用空气冷凝管缓缓回流加热45min。由于反应中二氧化碳逸出,可观察到反应初期有大量泡沫出现。
②反应完毕,在搅拌下向反应液中分批加入20 mL水,再慢慢加入碳酸钠中和反应液至pH等于8。然后进行水蒸气蒸馏(如图乙),待三口烧瓶中的剩余液体冷却后,加入活性炭煮沸10-15 min,进行趁热过滤。在搅拌下,将HCl加入到滤液中,当固体不在增加时,过滤,得到产品,干燥,称量得固体3.0 g。
IV:如图所示装置:
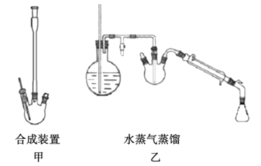
回答下列问题:
(1)合成时装置必须是干燥的,理由是___________。反应完成后分批加人20mL水,目的是________。
(2)反应完成后慢慢加入碳酸钠中和,目的是_____。
(3)步骤②进行水蒸气蒸馏,除去的杂质是______,如何判断达到蒸馏终点__________。
(4)加入活性炭煮沸10- 15 min,进行趁热过滤,将滤液冷却至室温,趁热过滤的目的是_______。
(5)若进一步提纯粗产品,应用的操作名称是______,该实验产品的产率约是_______。(保留小数点后一位)
【答案】防止乙酸酐与水反应 除去过量的乙酸酐 慢慢加入碳酸钠,容易调节溶液的pH 苯甲醛 蒸出、接收的无色液体不呈油状时,即可断定水蒸气蒸馏结束 增大肉桂酸的溶解度,提高产率 重结晶 67.6%
【解析】
苯甲醛和乙酸酐、碳酸钾在三颈烧瓶中反应生成肉桂酸盐和乙酸盐和二氧化碳,为了提高原料利用率,不断回流冷凝,由于反应产生二氧化碳,可观察到反应产生一定量的泡沫。由于乙酸酐能和水发生水解反应,故反应结束,过量的乙酸酐通过缓慢加入20mL水除去,慢慢加入碳酸钠调解pH=8,未反应的苯甲醛通过蒸馏的方式除去,当蒸出、冷凝的液体不成油状时,说明苯甲醛除尽。此时溶液中主要成分为肉桂酸盐和乙酸盐,加入活性炭煮沸、过滤得到含肉桂酸盐的滤液,往滤液中加HCl可生成肉桂酸,由于肉桂酸在水中的溶解度很小,可得肉桂酸晶体,此时肉桂酸中仍然还有一些可溶性的杂质,如乙酸,可通过重结晶进行提纯,得到纯净的肉桂酸。
(1)由题目所给信息可知,反应物乙酸酐遇水反应,故合成时装置必须是干燥,也因为乙酸酐能和水反应,实验结束剩余的乙酸酐能用水除去,所以,反应完成后分批加人20mL水,是为了除去过量的乙酸酐,故答案为:防止乙酸酐与水反应;除去过量的乙酸酐;
(2)慢慢加入碳酸钠,容易调节溶液的pH,故答案为:慢慢加入碳酸钠,容易调节溶液的pH;
(3)第①步将乙酸酐、乙酸除去了,此时进行水蒸气蒸馏,能除苯甲醛,苯甲醛是无色液体,在水中的溶解度很小,故蒸出、接收的苯甲醛液体应呈无色油状,所以,当苯甲醛完全蒸出时,将不再出现无色油状液体,故答案为:苯甲醛;蒸出、接收的无色液体不呈油状时,即可断定水蒸气蒸馏结束;
(4)过滤,活性炭等杂质留在滤渣里,肉桂酸留在滤液里,常温下,肉桂酸的溶解度很小,趁热过滤,是为了增大肉桂酸的溶解度,提高产率,故答案为:增大肉桂酸的溶解度,提高产率;
(5)此时肉桂酸中仍然还有一些可溶性的杂质,如乙酸,可通过重结晶进行提纯,得到纯净的肉桂酸。由制备肉桂酸的方程式可知,乙酸酐和苯甲醛按物质的量1:1反应,但是所给原料量为:0. 03 mol苯甲醛、0. 084 mol乙酸酐,很明显,乙酸酐过量,按苯甲醛的量计算,理论上可得0.03mol肉桂酸,对应质量=0.03mol×148.16g/mol=4.4448g,所以,产率=![]() =67.6%,故答案为:重结晶;67.6%。
=67.6%,故答案为:重结晶;67.6%。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法不正确的是( )
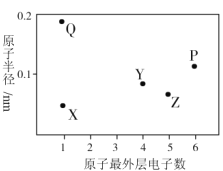
A.Q与氧形成的某化合物中可能含有离子键和非极性键
B.最高价氧化物对应水化物的酸性:Z<Y
C.P的最低价氢化物水溶液久置于空气中会产生浑浊
D.简单离子半径大小为:P>Z>Q>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平;B是一种比水轻的油状液态烃,0.1mol该烃在足量的氧气中完全燃烧,生成0.6molCO2和0.3mol水。回答下列问题:
(1)A 的电子式为_____,B 的结构简式为______。
(2)与A 相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:____,反应类型:____。
(3)在碘水中加入B物质,充分振荡、静置后的现象:_________。
(4)B与浓硫酸和浓硝酸在55~60℃条件下反应的化学方程式:_______,反应类型:______。
(5)等质量的A、B完全燃烧时消耗O2的物质的量:_______(填“A>B”“A<B”或“A=B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A. 在AgBr饱和溶液中加入AgNO3溶液,达到平衡时,溶液中Br-浓度降低
B. 利用电解法精炼粗铜时,精铜板做阴极,粗铜做阳极,CuSO4溶液做电解液
C. FeCl3溶液加热蒸干、灼烧得到Fe2O3
D. 用惰性电极电解MgCl2溶液,阴极得到单质Mg,阳极得到Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯的结构简式可用![]() 来表示,下列关于苯的叙述中正确的是
来表示,下列关于苯的叙述中正确的是
A. 苯主要是以石油为原料而获得的一种重要化工原料
B. 苯中含有碳碳双键,所以苯属于烯烃
C. 苯分子中6个碳碳化学键完全相同
D. 苯可以与溴水、高锰酸钾溶液反应而使它们褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。
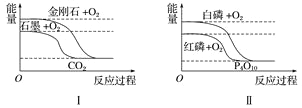
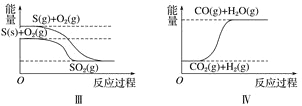
据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应 B. 白磷比红磷稳定
C. S(g)+O2(g)===SO2(g) ΔH1S(s)+O2(g)=SO2(g) ΔH2 则ΔH1>ΔH2 D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,针对表中①~⑧元素,回答下列问题
① | |||||||||||||||
② | ③ | ④ | |||||||||||||
⑤ | ⑥ | ⑦ | ⑧ |
(1)③元素在周期表中的位置是第二周期第_____________族
(2)写出②的最高价氧化物的电子式_____________
(3)⑤和⑥两种元素的最高价氧化物对应水化物中碱性较强的是_____________(填化学式)
(4)写出③和⑦的常见氢化物中稳定性较好的的物质的电子式_____________
(5)写出⑤⑧的最高价氧化物对应水化物互相反应的离子方程式_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐增大
D.![]() Cl与
Cl与![]() Cl得电子能力相同
Cl得电子能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
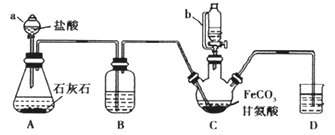
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
有关物质性质如下表
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
Ⅰ合成:装置C中盛有0.2 mol FeCO3和200 mL 1.0 mol·L1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置C中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器C的名称是___________;与a相比,仪器b的优点是_______。
(2)装置B盛装的试剂为_____________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和______________。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________________。
(5)过程II中洗涤操作为________。
(6)检验产品中是否含有Fe3+的最佳试剂是_________(写化学用语)。
(7)本实验制得15.3 g 甘氨酸亚铁(M=204g/mol),则其产率是_______%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com