
| 实验序号 | 金属 状态 | c(H2SO4) /mol?L-1 | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 丝 | 0.7 | 20 | 36 | 250 |
| 2 | 丝 | 0.8 | 20 | 35 | 200 |
| 3 | 粉末 | 0.8 | 20 | 35 | 25 |
| 4 | 丝 | 1.0 | ? | 35 | 125 |
| 5 | 丝 | 1.0 | 35 | 50 | 50 |


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
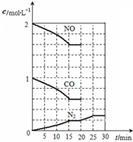 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(K) | 273 | 293 | 313 | 333 | 353 | 373 |
| Ca(OH)2溶解度(g/100g H2O) | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. | |
| 步骤2:取适量滤液于试管中,滴加足量草酸H2C2O4. | 出现白色沉淀(CaC2O4),说明该试剂中有Ca2+存在. |
| 步骤3:取适量步骤1中的沉淀于试管中, | |
| 步骤4: | 现象是 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 生成铝的产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成.请回答下列问题:
生成铝的产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成.请回答下列问题:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在一定温度和压强下,各种气态物质体积大小由分子间距离决定 |
| B、相同温度时,CO2和N2O若体积相同,则它们的质量一定相同 |
| C、100g浓度为18mol/L的浓硫酸中加入等质量的水稀释浓度大于9mol/L |
| D、14 mol/L的H2SO4溶液的溶质质量分数为80%,那么7 mol/L的H2SO4溶液的溶质质量分数将大于40% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤经过气化和液化等物理变化可以转化为清洁燃料 |
| B、在海轮外壳上镶入锡块,可减缓船体的腐蚀速率 |
| C、光化学烟雾的形成与汽车尾气中的氮氧化物有关 |
| D、“鸟巢”使用钒氮合金钢,该合金熔点、硬度和强度均比纯铁高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com