
【题目】回答下列问题:
(1)在一个恒温恒容的密闭容器中,可逆反应N2(g)+3H2(g)2NH3(g)
△H<0达到平衡的标志是(填编号)
①反应速率v(N2):v(H2):v(NH3)=1:3:2
②各组分的物质的量浓度不再改变
③体系的压强不再发生变化
④混合气体的密度不变
⑤单位时间内生成n mol N2的同时,生成3n mol H2
⑥2V(N2正)=V(NH3逆)
⑦单位时间内3mol H﹣H键断裂的同时2mol N﹣H键也断裂
⑧混合气体的平均相对分子质量不再改变
(2)现有八种物质:①干冰;②金刚石;③四氯化碳;④晶体硅;⑤过氧化钠;⑥碳化硅晶体;⑦溴化钠;⑧氖.请用编号填写下列空白:
A.属于原子晶体的是 , 其中熔点由高到低的顺序为
B.属于分子晶体的是 , 其中分子构型为正四面体的化合物的电子式为
C.既含有共价键又含有离子键的化合物是 , 其中阳离子个数与阴离子个数之比为 .
【答案】
(1)②③⑥⑧
(2)②④⑥;②⑥④;①③⑧;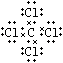 ;⑤;2:1
;⑤;2:1
【解析】解:(1)①速率之比等于对应物质的化学计量数之比,反应开始后一直成立,不能说明反应达到平衡状态,故①错误;②当体系达平衡状态时,反应混合物各组分的物质的量浓度不变,故②正确;③该反应正方向为计量数减小的反应,随着反应进行压强不断减小,当压强不变时,反应达到平衡状态,故③正确;④反应容器的体积不变,气体的质量守恒,所以密度始终不变,密度不变时不能说明反应达到平衡状态,故④错误;⑤单位时间内生成n mol N2表示逆速率,生成3n mol H2表示逆速率,都表示逆速率,不能说明反应达到平衡状态,故⑤错误⑥2V(N2正)=V(NH3逆),即氮气的正速率与氨气的逆速率之比等于计量数之比,则反应达到平衡状态,故⑥正确;⑦单位时间内3molH﹣H键断裂等效于6mol N﹣H键形成,同时6mol N﹣H键断裂,⑦错误;⑧混合气体的物质的量逐渐减小,质量不变,则平均相对分子质量逐渐增大,当平均相对分子质量不变时,即是平衡状态,故⑧正确;所以答案是:②③⑥⑧;(2)A.②金刚石、④晶体硅、⑥碳化硅是通过非极性键形成的原子晶体;②金刚石是熔点最高的晶体C﹣Si键长小于Si﹣Si,熔点:碳化硅>晶体硅;
所以答案是:②④⑥;②⑥④;B.①干冰是直线型分子,属于分子晶体;③四氯化碳是正四面体型分子晶体;⑧氖是由单原子分子构成的分子晶体四氯化碳的电子式为 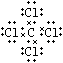 ;所以答案是:①③⑧;
;所以答案是:①③⑧; 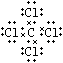 ;C.⑤过氧化钠既含有离子键,又含有非极性共价键,其阳离子个数与阴离子个数之比为2:1,所以答案是:⑤;2:1.
;C.⑤过氧化钠既含有离子键,又含有非极性共价键,其阳离子个数与阴离子个数之比为2:1,所以答案是:⑤;2:1.
【考点精析】解答此题的关键在于理解化学平衡状态的判断的相关知识,掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.


科目:高中化学 来源: 题型:
【题目】常温下,向10 mL 1 mol/L HCl溶液中滴加等物质的量浓度的CH3COONa溶液。所得混合液的pH与加入CH3COONa溶液的体积(V)的变化如下图所示。下列说法不正确的是

A. 常温下,CH3COOH的电离常数约为2×10-5
B. 随着V的增加,混合液中水的电离程度先增加后减小
C. 当V=20mL时,混合液中c(Na+) >c(CH3COO-)> c(Cl-)>c(H+) >c(OH-)
D. 当混合液的pH=7时,混合液中c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
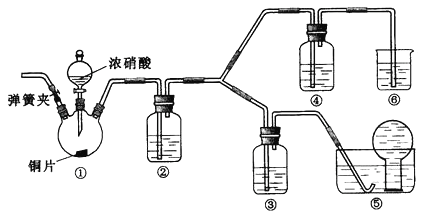
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应![]()
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是_________
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹后_________
(3)装置①中发生反应的化学方程式是__________
(4)装置②的作用是_________,发生反应的化学方程式是___________
(5)该小组得出的结论所依据的试验现象是____________
(6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下3个实验来判断两种看法是否正确。这些方案中可行的是___(选填序号字母)
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表如示。下列判断中正确的是
甲 | 乙 | 丙 | 丁 | ||
容器的体积/L | 2 | 2 | 2 | 1 | |
起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
A. 甲中反应的平衡常数小于乙 B. 该温度下,该反应的平衡常数K为400
C. SO2的平衡转化率:α1>α2=α3 D. 容器中SO3的物质的量浓度:丙=丁<甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与 H2O(g)发生反应:CH4(g)+H2O(g) ![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时φ(CH4)的体积分数与 Z 和 T(温度)的关系如图所示。下列说法正确的是
=Z,在恒压下,平衡时φ(CH4)的体积分数与 Z 和 T(温度)的关系如图所示。下列说法正确的是

A. 该反应的焓变 ΔH>0
B. 图中 Z 的大小为 a>3>b
C. 图中 X 点对应的平衡混合物中![]()
D. 温度不变时,图中X 点对应的平衡在加压后φ(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应:N2+3H2![]() 2NH3,H<0,达到平衡时,当单独改变下列条件后,有关叙述错误的是( )
2NH3,H<0,达到平衡时,当单独改变下列条件后,有关叙述错误的是( )
A. 加催化剂V正、V逆都发生变化且变化的倍数相等
B. 降温,V正、V逆都减小,且V正减小倍数小于V逆减小倍数
C. 加压,V正、V逆都增大,且V正增大倍数大于V逆增大倍数
D. 加入氩气,V正、V逆都增大,且V正增大倍数大于V逆增大倍数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com