
【题目】Ⅰ、在528K、固定计提的容器中,反应CO(g)+2H2(g)CH3OH(g)过程中能量变化如图所示,曲线Ⅱ表示使用催化剂时的能量变化,若投入a molCO、2amolH2,平衡时能生成0.1amolCH3OH,反应就具工业应用价值。
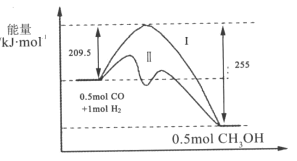
(1)该反应的热化学方程式为______;
(2)若按上述投料比使该反应具有工业应用价值,CO的平衡转化率为______;
(3)在容器容积不变的前提下,欲提高H2的转化率,可采取的措施______;(答出两项即可)
(4)关于反应历程Ⅰ与反应历程Ⅱ相比较,下列说法正确的是______;
A.反应历程Ⅱ比反应历程Ⅰ放出的热量少
B.反应历程Ⅱ比反应历程Ⅰ反应速率快
C.反应历程Ⅱ比反应历程Ⅰ平衡常数小
D.反应历程Ⅱ和反应历程Ⅰ中CO转化率相同
Ⅱ、已知:N2(g)+3H2(g)2NH3(g)△H=-92.1kJ/mol,在容器中充入1.4mol/LN2与4 mol/LH2,其中N2与NH3在达到平衡后改变某条件下的浓度变化如图所示
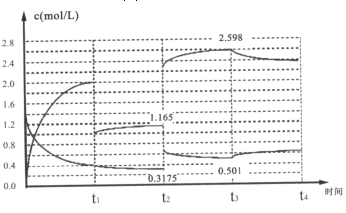
(5)t2时刻改变的条件为______;
(6)t2=t3时刻的平衡常数为______(mol/L)-2。
【答案】CO(g)+2H2(g)CH3OH(g)△H=-91kJ/mol 10% 增大CO浓度;适当降低温度(或及时分离生成的CH3OH) BD 增大压强 10
【解析】
Ⅰ、(1)图象分析可知反应生成0.5mol甲醇的焓变△H=209.5kJ/mol-255 kJ /mol=--45.5 kJ /mol,反应CO(g)+2H2(g)CH3OH(g)的焓变△H=-91 kJ /mol,标注物质聚集状态和对应反应的焓变写出反应的热化学方程式;
(2)转化率=参加反应的CO的物质的量与最初CO的物质的量之比;
(3)要提高H2的转化率,可以采取增大CO浓度、适当降低温度、及时分离生成的CH3OH的方法;
(4)催化剂对可逆反应的影响是降低反应的活化能,几块反应速率,不改变化学平衡;
Ⅱ、(5)图象分析可知,t2时刻改变条件氮气浓度增大,氨气浓度增大,随后氨气浓度增大,氮气浓度减小说明是改变的压强,平衡正向进行;
(6)t2时刻平衡常数和t3平衡常数不变,平衡常数K=![]() ;
;
Ⅰ、(1)图象分析可知反应生成0.5mol甲醇的焓变△H=209.5 kJ /mol-255 kJ /mol=--45.5 kJ /mol,反应CO(g)+2H2(g)CH3OH(g)的焓变△H=-91 kJ /mol,标注物质聚集状态和对应反应的焓变写出反应的热化学方程式为:CO(g)+2H2(g)CH3OH(g)△H=-91 kJ /mol,
故答案为:CO(g)+2H2(g)CH3OH(g)△H=-91 kJ /mol;
(2)若按上述投料比使该反应具有工业应用价值,根据方程式知,参加反应的一氧化碳和生成的甲醇的物质的量相等,所以CO的平衡转化率为:![]() ×100%=10%,
×100%=10%,
故答案为:10%;
(3)可以采取增大CO浓度、适当降低温度、及时分离生成的CH3OH的方法来促使平衡向正反应方向移动,从而提高氢气的转化率,
故答案为:增大CO浓度;适当降低温度(或及时分离生成的CH3OH);
(4)使用催化剂,只能改变反应速率,不能改变化学平衡,则不会改变反应的焓变、不会影响反应物转化率、不影响化学平衡常数,
A.反应历程Ⅱ和反应历程Ⅰ放出的热量相同,故A错误;
B.反应历程Ⅱ降低了反应的活化能,反应速率比反应历程Ⅰ反应速率快,故B正确;
C.反应历程Ⅱ比反应历程Ⅰ温度不变,平衡常数不变,故C错误;
D.反应历程Ⅱ和反应历程Ⅰ反应速率不同,达到相同平衡状态,反应中CO转化率相同,故D正确;
故答案为:BD;
Ⅱ、(5)图象分析可知,t2时刻改变条件氮气浓度增大,氨气浓度增大,随后氨气浓度增大,氮气浓度减小说明是改变的压强,平衡正向进行,t2改变的条件是增大压强,
故答案为:增大压强;
(6)t2时刻平衡常数和t3平衡常数不变,c(N2)=0.3175mol/L,t1时刻分离氨气1mol/L,平衡状态c(NH3)=1.165mol/L,c(H2)=4mol/L-2×1.165mol/L=0.7525mol/L
平衡常数K=![]() ≈10,
≈10,
故答案为:10。


科目:高中化学 来源: 题型:
【题目】下列对阿伏加德罗定律及推论的理解不正确的是( )
A.同温同压下,气体的体积之比等于它们的物质的量之比
B.同温同压下,气体的体积之比等于它们的质量之比
C.同温同压下,相同体积的气体质量比等于它们的相对分子质量之比
D.同温同压下,气体的密度之比等于它们的相对分子质量之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用铝土矿和硫铁矿烧渣(配料中含Al2O3、Fe2O3,FeO及SiO2等)为原料制备无机高分子絮凝剂聚合碱式氯化铝铁的流程如下:
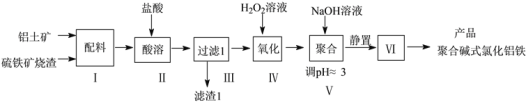
(1)步骤Ⅱ酸溶时,Fe2O3被溶解的化学程式为____,滤渣1的成分为____(填化学式)。
(2)步骤Ⅳ发生反应的离子方程式为________________。
(3)步骤V若将溶液pH调成6,可能造成的影响是_______;步骤Ⅵ包含的操作有_______。
(4)测定聚合碱式氯化铝铁{可表示为[FeaAlb(OH)xCly]n}中n(Al)/n(Fe)的比值的步骤如下:
步骤1.准确称取产品5.710g溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到3.350 g固体。
步骤2.另准确称取2.855g样品,溶于足量NaOH溶液,过滤,充分洗涤,将滤渣灼烧至质量不再变化,得到固体0.4000g。
计算产品中n(Al)/n(Fe)的比值(写出计算过程)。__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚锡用途广泛,在无机工业中用作还原剂,在口腔护理行业中,二水氯化亚锡多用于防龋齿脱敏类牙膏中,以预防龋齿的发生。某研究小组制取二水氯化亚锡工艺流程如下:

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。
(1)四氯化锡暴露于空气中与空气中水分反应生成白烟,有强烈的刺激性气味,生成偏锡酸(H2SnO3),写出该反应的化学方程式______;
(2)将金属锡熔融,然后泼入冷水,激成锡花,其目的是______;
(3)在制备二水氯化亚锡时,温度对锡转化率的影响如图1所示,则该反应应控制的温度范围为______℃;

(4)反应原料中盐酸浓度对结晶率的影响如图2所示,则盐酸浓度应控制的范围为______,原因______。
(5)反应釜中发生反应的化学方程式为______;
(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应)
①将该试样溶于盐酸,发生反应为Sn+2HCl=SnCl2+H2↑;
②加入过量FeCl3溶液
③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,则反应的离子方程式为______;
(7)取1.125g锡粉,经上述各步反应后,共用去0.1000mol/LK2Cr2O7溶液 30.00mL,锡粉中锡的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(已知lg5=0.7)室温下,下列有关溶液pH的说法正确的是 ( )
A. 将pH=11的NaOH溶液加水稀释100倍,溶液中c(H+)=1×10-13 mol·L-1
B. 将pH=9的NaOH溶液和pH=13的Ba(OH)2溶液等体积混合,所得混合溶液的pH=11
C. 将0.1mol/L的H2SO4和pH=5的HCl等体积混合,所得混合溶液的pH=1
D. pH=13的Ba(OH)2溶液和pH=1的HCl等体积混合,由于Ba(OH)2过量,所得溶液的pH>7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于同分异构体判断正确的是
A. 甲苯的一氯代物有4种
B. 分子式为C8H10的芳香烃有3种
C. 分子式为C4H8的烯烃同分异构体有2种,分别为CH2=CHCH2CH3、CH3CH=CHCH3
D. 二氯甲烷有两种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求计算并填空
(1)32gSO2标况下的体积为____________L,含有______________个氧原子。
(2)1.204×1023个NH3分子所含的氢原子数与________mol CH4含有的氢原子数相同。
(3)标况下,某CO2和H2混合气体的密度为1.25g/L,则混合气体中CO2和H2的体积比约为______________。
(4)200 mL某硫酸盐溶液中含SO42- 1.5 NA个,含金属离子NA个,则该硫酸盐溶液的物质的量浓度为________mol/L。
(5)把VmL含有Al2(SO4)3和(NH4)2SO4的混合溶液分成两等份,一份加入含足量NaOH的溶液并加热,铵根离子完全反应生成a mol NH3(已知NH4++OH-![]() NH3↑+H2O);另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中Al3+的浓度为_____________mol/L。
NH3↑+H2O);另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中Al3+的浓度为_____________mol/L。
(6)将20.0g质量分数为14.0%的 NaNO3溶液与30.0g质量分数为24.0%的NaNO3溶液混合,得到的密度为1.15g/cm3的混合溶液。混合后溶液的物质的量浓度为______(结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图的装置进行电解实验:A极是铜锌合金,B为纯铜。电解质溶液中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极质量增加9.6g,溶液质量增加0.05g,则A极合金中Cu、Zn原子个数比为

A. 4:1 B. 1:1 C. 2:1 D. 任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有铁的氧化物样品,用150 mL 5 mol/L的盐酸恰好使其完全溶解,所得溶液还能吸收标准状况下氯气1.68L,使其中的Fe2+全部转化为Fe3+,该样品可能的化学式是( )
A.Fe2O3B.Fe3O4C.Fe5O7D.Fe4O5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com