
【题目】(已知lg5=0.7)室温下,下列有关溶液pH的说法正确的是 ( )
A. 将pH=11的NaOH溶液加水稀释100倍,溶液中c(H+)=1×10-13 mol·L-1
B. 将pH=9的NaOH溶液和pH=13的Ba(OH)2溶液等体积混合,所得混合溶液的pH=11
C. 将0.1mol/L的H2SO4和pH=5的HCl等体积混合,所得混合溶液的pH=1
D. pH=13的Ba(OH)2溶液和pH=1的HCl等体积混合,由于Ba(OH)2过量,所得溶液的pH>7
【答案】C
【解析】
A.将pH=11的氢氧化钠溶液中氢氧根离子浓度为10-3 mol/L,加水稀释100倍,溶液中氢氧根离子浓度是10-5 mol/L,则c(H+)=10-9mol/L,故A错误;B.氢氧化钠和氢氧化钡都是强电解质,所以两种溶液等体积混合时,氢氧根离子浓度等于二者氢氧根离子浓度的一半,即混合溶液中氢氧根离子浓度=![]() (105+101)mol/L≈0.05,所以氢离子浓度2×10-13mol/L,则溶液的pH大于11,故B错误;C.0.1mol/L的H2SO4中氢离子浓度为0.2mol/L,氯化氢和硫酸都是强电解质,两种溶液等体积混合时,离子浓度等于二者氢离子浓度的一半,即混合溶液的氢离子浓度约等于0.1mol/L,则混合溶液的pH=1,故C正确;D.pH=13的氢氧化钡溶液和pH=1的盐酸等体积混合,氢离子和氢氧根离子的物质的量相等,所以氢离子和氢氧根离子恰好反应,溶液呈中性,pH=7,故D错误;故选C。
(105+101)mol/L≈0.05,所以氢离子浓度2×10-13mol/L,则溶液的pH大于11,故B错误;C.0.1mol/L的H2SO4中氢离子浓度为0.2mol/L,氯化氢和硫酸都是强电解质,两种溶液等体积混合时,离子浓度等于二者氢离子浓度的一半,即混合溶液的氢离子浓度约等于0.1mol/L,则混合溶液的pH=1,故C正确;D.pH=13的氢氧化钡溶液和pH=1的盐酸等体积混合,氢离子和氢氧根离子的物质的量相等,所以氢离子和氢氧根离子恰好反应,溶液呈中性,pH=7,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+ 5O2(g)![]() 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
A. 达到化学平衡时,4υ正(O2)= 5υ逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D. 化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g)ΔH=-226kJ/mol
O2(g)ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A. CO的燃烧热为283 kJ
B. 如图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题。每位考生只可选做1题,若两题都作答,则以A题计分。
A.《化学与生活》
(1)材料与人类吃、穿、住、行、用、医疗、通信等密切相关
①下列分子式或结构简式可表示维生素C的______(填字母)。
a.C6H8O6 b.C6H10O6 c.
②玻璃钢门窗被国际上称为继木、钢、铝、塑之后的第五代门窗产品。玻璃钢属于下列材料中的____(填字母)。
a.金属材料 b.无机非金属材料 c. 复合材料
③黏土是陶瓷的生产原料,其主要组成可表示为Al2Si2Ox(OH)4,则x=______(填字母)。
a.1 b.3 c.5
(2)绿色发展可使 “天更蓝,水更清,空气更清新,生活更美好”。
①传统的一次性塑料袋有聚氯乙烯、氯乙烯等,它们在环境中难降解易造成白色污染,合成聚氯乙烯的单体为_____(写结构简式)。
②燃煤产生的NO2是形成硝酸型酸雨的元凶,在催化剂及加热条件下用NH3与NO2反应可生成无毒无污染的气体,该反应的化学方程式为______。
③含铬(Cr2O72ˉ)的酸性废水处理方法之一可采用(NH4)2Fe(SO4)2将Cr2O72ˉ还原为Cr3+,再用氨水将Cr3+转变成难溶的Cr(OH)3。该方案运用了污水处理方法中的沉淀法和______。处理后的废水中因含有大量_____(填离子符号),能导致水体富营养化,还需进一步处理。
(3)保持营养平衡,合理使用药物是保证身心健康、提高生活质量的有效手段。
①有些氨基酸人体自身不能合成,要从外界才能获得,这些氨基酸称为________。苹果中含有一定量的铁元素,人体缺铁会导致的疾病是_____。
②含碘食盐中添加有KIO3,可用KI、盐酸及淀粉溶液检验,该反应的离子方程式为_______。
③人类历史上最重要的抗生素是_____(填名称);“铝镁加”是一种新型的抗酸剂,它的主要成分的化学式为:Al2Mg6(OH)14(CO3)2·4H2O,它与胃酸主要成分反应的化学方程式为______。
B.《有机化学基础》
(1)有机化合物的结构对其性质有着重要的影响。
①下列有机物易溶于水的是____(填字母)。
a. 乙烷 b.乙醇 c.乙酸乙酯
②下列有机物常温下呈气态的是_____(填字母)。
a.正丁烷 b.苯 c.溴乙烷
③分子式为C2H4O2的有机物中既能发生银镜反应又能发生水解反应的是_____(填字母)。
a.CH3COOH b.HOCH2CHO c. HCOOCH3
(2)芴酮可用作工程塑料的改进剂。某芴酮可通过下列反应得到:

①化合物Ⅱ中含氧官能团为____和_____(写名称)。
②鉴别化合物Ⅰ和化合物Ⅱ可用的试剂为_____(写化学式)。
③1mol化合物Ⅰ最多可与_____molNaOH完全反应。
(3)囧烷(E)的一种合成路线如下:
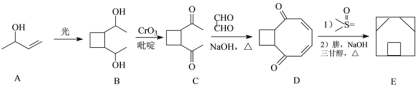
①A→B的反应类型为_____;B中手性碳原子数目为_____(填数字)。
②E的分子式______;A可用于合成一种常见的人造橡胶的单体,由A制备该单体的化学方程式为______。
③满足下列条件的D的同分异体的结构简式为_____。
Ⅰ.含有1个苯环,无其它环状结构,能与FeCl3溶液发生显色反应。
Ⅱ.核磁共振氢谱有4组峰且面积比为3∶3∶2∶2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中,正确的是
A.镁合金的硬度、强度、熔点均高于纯镁
B.我国流通的硬币材质是纯金属
C.湿法炼铜过程中发生了置换反应
D.明矾能净水,主要原因是其在溶液中形成的Al(OH)3胶体能消毒、杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、在528K、固定计提的容器中,反应CO(g)+2H2(g)CH3OH(g)过程中能量变化如图所示,曲线Ⅱ表示使用催化剂时的能量变化,若投入a molCO、2amolH2,平衡时能生成0.1amolCH3OH,反应就具工业应用价值。
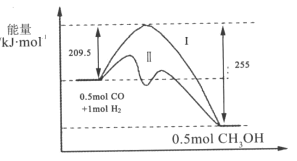
(1)该反应的热化学方程式为______;
(2)若按上述投料比使该反应具有工业应用价值,CO的平衡转化率为______;
(3)在容器容积不变的前提下,欲提高H2的转化率,可采取的措施______;(答出两项即可)
(4)关于反应历程Ⅰ与反应历程Ⅱ相比较,下列说法正确的是______;
A.反应历程Ⅱ比反应历程Ⅰ放出的热量少
B.反应历程Ⅱ比反应历程Ⅰ反应速率快
C.反应历程Ⅱ比反应历程Ⅰ平衡常数小
D.反应历程Ⅱ和反应历程Ⅰ中CO转化率相同
Ⅱ、已知:N2(g)+3H2(g)2NH3(g)△H=-92.1kJ/mol,在容器中充入1.4mol/LN2与4 mol/LH2,其中N2与NH3在达到平衡后改变某条件下的浓度变化如图所示
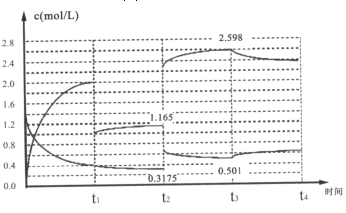
(5)t2时刻改变的条件为______;
(6)t2=t3时刻的平衡常数为______(mol/L)-2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。
回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。

若草酸晶体分解的产物中有CO2,则装置C中可观察到的现象是_____________________,装置B的主要作用是____________________________________。
(2)乙组同学认为草酸晶体分解产物除CO2外还有CO,为进一步验证CO的存在,选用甲组实验中的装置A、B和下图所示部分装置(可以重复选用)进行实验,装置G干燥管中装有的无水氯化钙是干燥剂,可以除去气体中的水分。



①乙组同学的实验装置中,依次连接的合理顺序为A、B、__________________。装置H硬质玻璃管中盛有的物质是______________________。
②能证明草酸晶体分解产物中有CO的现象是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Al、CuO、Fe2O3组成的混合物共10.0g,放入500mL某浓度的盐酸中,混合物完全溶解,当再加入250mL 2.00mol/L的NaOH溶液时,得到沉淀最多。上述盐酸的浓度为( )
A. 1.00 mol/LB. 0.500 mol/L
C. 2.00 mol/LD. 3.00 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com