
【题目】Ⅰ.稀氨水中存在平衡:NH3 + H2O![]() NH4+ + OH- ,如进行下列操作,则下列物理量如何变化?试用“增大”‘减小”“不变”填写。
NH4+ + OH- ,如进行下列操作,则下列物理量如何变化?试用“增大”‘减小”“不变”填写。
(1)通适量HCl气体时,c(NH3)____________,c(OH-)__________________
(2)加入NH4Cl晶体时,c(NH4+)___________,平衡常数K_______________
Ⅱ.已知室温时,0.1 mol·L-1的某一元酸HA在水中有 0.1% 发生电离,回答下列各问题:
(1)该溶液的pH=________。
(2)HA的电离平衡常数K=________。
(3) 若在95℃时,上述溶液中水电离的H+浓度为____________(此时KW=10-12)。
Ⅲ.常温下有pH为12的NaOH溶液20 mL,加入某溶液,将其pH变为11(设溶液体积可直接相加;计算结果保留到小数点后一位)。
(1)若用pH = 10的NaOH溶液,应加入NaOH溶液_________mL;
(2)若用pH = 2的盐酸,应加入盐酸___________mL;
【答案】减小 减小 增大 不变 4 1×10-7 10-8mol/L 200.0 16.4
【解析】
Ⅰ.根据NH3+H2ONH3H2ONH4++OH-知,向氨水中加入酸,氢离子和氢氧根离子反应生成水,导致平衡右移,从而促进氨水电离,向氨水中加入氯化铵,导致溶液中铵根离子浓度增大,平衡向左移动,从而抑制氨水电离,据此分析解答。
Ⅱ.(1)HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L;
(2)由HAH++A-,c(H+)=c(A-)=10-4mol/L,则电离平衡常数为![]() =1×10-7;
=1×10-7;
(3)温度升高促进电离;HA电离出的c(H+)为0.1mol/L×0.1%,利用Kw来计算水电离产生的氢离子浓度。
Ⅲ. (1)先根据溶液的pH计算氢氧根离子浓度,再根据C1V1+C2V2=C3(V1+V2)计算加入的氢氧化钠溶液体积;
(2)先计算混合溶液中氢氧根离子浓度,再根据c(OH-)=![]() 。
。
Ⅰ(1)向氨水中同适量的氯化氢气体,氯化氢溶于水电离出氢离子,氢离子和氢氧根离子反应生成水,导致平衡右移,则溶液中氨气浓度减小,溶液的碱性减弱,所以溶液中氢氧根离子浓度减小,
故答案为:减小;减小;
(2)向氨水中加入氯化铵,氯化铵电离出铵根离子,所以溶液中铵根离子浓度增大,平衡向左移动,从而抑制氨水电离,电离平衡常数只受温度的影响,
故答案为:增大;不变;
Ⅱ.(1)HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,则pH=-lg(10-4)=4,
故答案为:4;
(2)由HAH++A-,c(H+)=c(A-)=10-4mol/L,则电离平衡常数为Ka=![]() =1×10-7,
=1×10-7,
故答案为:1×10-7;
(3)HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,水电离产生的氢氧根离子为![]() mol/L=10-8mol/L,而水电离氢离子浓度等于氢氧根离子的浓度,水电离氢离子浓度为10-8mol/L,
mol/L=10-8mol/L,而水电离氢离子浓度等于氢氧根离子的浓度,水电离氢离子浓度为10-8mol/L,
故答案为:10--8;
Ⅲ. (1)pH=12的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,pH=10的氢氧化钠溶液中氢氧根离子浓度是0.0001mol/L,
设加入pH=10的NaOH溶液体积是V2,C1V1+C2V2=C3(V1+V2)则0.01mol/L×0.02L+0.0001mol/L×V2=0.001mol/L(0.02+V2),V2=0.2L=200.0mL,
故答案为:200.0;
(2)pH=2的HCl溶液中氢离子浓度是0.01mol/L,设加入盐酸的体积是V,c(OH)=![]() =
=![]() =0.001mol/L,
=0.001mol/L,
解得:V=16.4mL,
故答案为:16.4。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)═2SO3(g)△H<0
(1)如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用O2浓度变化来表示的反应速率为___。
(2)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图1所示。根据图示回答下列问题:

该反应的平衡常数的表达式为___,平衡状态由A变到B时,平衡常数K(A)___K(B)(填“>”、“<”或“=”)。
(3)图2表示该反应在密闭容器中达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a-b过程中改变的条件可能是___;b-c过程中改变的条件可能是___;若增大压强时,反应速度变化情况画在c~d处___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 阿司匹林(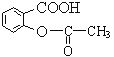 )能解热镇痛。
)能解热镇痛。
(1)阿司匹林属于__________(填“无机化合物”或“有机化合物”)。
(2)阿司匹林中含氧官能团有酯基和__________(填名称)。
(3)向阿司匹林的水溶液中滴入2~3滴紫色石蕊溶液,溶液颜色变红,说明阿司匹林溶液具有________性。
(4)阿司匹林在一定条件下水解生成水杨酸(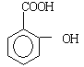 )和另一种酸A ,试写出另一种酸A的结构简式__________。
)和另一种酸A ,试写出另一种酸A的结构简式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下。
[实验目的] 测量锌和稀硫酸反应的速率。
[实验用品] 锥形瓶、双孔塞、分液漏斗、直角导管、50 mL注射器、铁架台、秒表、锌粒、1 mol·L-1的H2SO4、4 mol·L-1的H2SO4。
[实验步骤]
(1)甲同学取一套如图装置,加入40 mL 1 mol·L-1的H2SO4,测量收集10 mL H2所需的时间。

(2)乙同学取另一套同样的装置,加入40 mL 4 mol·L-1的H2SO4,测量收集10 mL H2所需的时间。
回答下列问题:
(1)Zn与稀H2SO4反应的离子方程式为________。
(2)收集10 mL H2所需时间:甲________(填“大于”“小于”或“等于”)乙。反应速率:甲________(填“大于”“小于”或“等于”)乙。
(3)下列说法正确的是________(填字母)。
A 本实验中甲、乙两同学所用锌粒的表面积要相同
B 装置气密性要好
C 40 mL的H2SO4要迅速加入
D 测量气体体积还可以用排水法
E 若用98%的浓H2SO4,则反应最快
(4)测定Zn和稀H2SO4反应的速率还可用的方法有:①___________; ②_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.①常温常压,0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量。写出热化学方程式:________________________________________________________
②4g氢气燃烧生成水蒸气放出484kJ热量,热化学方程式是_______________

Ⅱ.如图表示在密闭容器中反应:2SO2+O2![]() 2SO3, △H < 0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是__________;b c过程中改变的条件可能是____________; 若减小压强时,反应速度变化情况画在c~d处_______。
2SO3, △H < 0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是__________;b c过程中改变的条件可能是____________; 若减小压强时,反应速度变化情况画在c~d处_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中存在如下反应。2A(g)+B(g)![]() 3C(g)+D(s) H<0,在其他条件不变时,改变某一条件对上述平衡的影响,下列分析正确的是( )
3C(g)+D(s) H<0,在其他条件不变时,改变某一条件对上述平衡的影响,下列分析正确的是( )
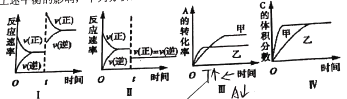
A.图Ⅰ表示增加生成物浓度对该平衡的影响
B.图Ⅱ表示增大压强对该平衡的影响
C.图Ⅲ表示温度对该平衡的影响,温度:乙>甲
D.图Ⅳ表示催化剂对该平衡的影响,催化效率:乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T0时,在容积固定的密闭容器中发生 ![]() 未配平
未配平![]() 反应,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为
反应,各物质浓度随时间变化的关系如图a所示。其他条件相同,温度分别为 ![]() 、
、![]() 时发生反应;Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
时发生反应;Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
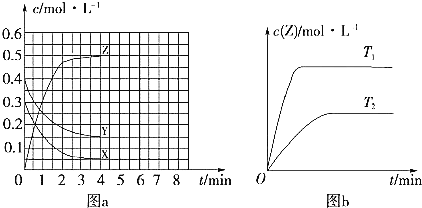
A.发生反应时,各物质的反应速率大小关系为![]()
![]() v
v![]()
B.图a中反应达到平衡时,Y的转化率为![]()
C.![]() 时,该反应的平衡常数为
时,该反应的平衡常数为![]()
D.该反应正反应的反应热![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,向某恒容密闭容器中加入1.6 molL-1的W后会发生如下反应:2W(g)=M(g) △H =a kJ mol-1。其中M的物质的量浓度随时间的变化如图所示:
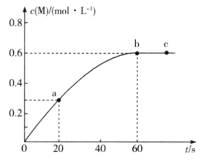
下列说法错误的是
A.从反应开始到刚达到平衡时间段内,υ(W) =0.02 molL-1s-1
B.a、b两时刻生成W的速率:υ(a)<υ(b)
C.用W浓度变化值表示的ab、bc两个时段内的反应速率:υ(ab)>υ(bc) =0
D.其他条件相同,起始时将0.2 mol L-1氦气与W混合,则反应达到平衡所需时间少于60 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中可进行反应A+B![]() C+D,其中A、B在一定条件下反应并测定反应中生成物C的浓度随反应时间的变化情况,绘制出如图所示的图线。(0~t1、t1~t2、t2~t3各时间段相同)下列说法不正确的是
C+D,其中A、B在一定条件下反应并测定反应中生成物C的浓度随反应时间的变化情况,绘制出如图所示的图线。(0~t1、t1~t2、t2~t3各时间段相同)下列说法不正确的是

A. 该反应是吸热反应
B. 反应速率最大的时间段是在t1~t2
C. 四个时间段内生成C的量最多的是t1~t2
D. 反应速率后来减慢主要是受反应物浓度变化的影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com