
【题目】常温下,将![]() 通入
通入![]() 的KOH溶液中。溶液中水电离出的
的KOH溶液中。溶液中水电离出的![]() 离子浓度
离子浓度![]() 与通入的
与通入的![]() 的体积
的体积![]() 的关系如图所示。下列叙述不正确的是
的关系如图所示。下列叙述不正确的是
 A
A
A.a点溶液中:水电离出的![]()
B.b点溶液中:![]()
C.c点溶液中:![]()
D.d点溶液中:![]()
【答案】B
【解析】
根据题中溶液中水电离出的![]() 离子浓度
离子浓度![]() 与通入的
与通入的![]() 的体积
的体积![]() 的关系可知,本题考查离子浓度大小比较,根据溶液中的溶质及其性质结合电荷守恒进行分析。
的关系可知,本题考查离子浓度大小比较,根据溶液中的溶质及其性质结合电荷守恒进行分析。
a点为氢氧化钾溶液,a到c是生成碳酸钾,b点是碳酸钾和氢氧化钾的混合溶液,c点是单一的碳酸钾溶液,c到d是生成碳酸氢钾,d点是碳酸氢钾和碳酸的混合溶液,d点溶液呈中性,
A.a点溶液中的溶质是KOH,氢氧化钾抑制了水的电离,溶液中氢离子是水电离的,则水电离出的![]() ,故A正确;
,故A正确;
B.b点是碳酸钾和氢氧化钾的混合溶液,所以溶液呈碱性,溶液中的![]() ,故B错误;
,故B错误;
C.c点溶液中,当水电离出的![]() 离子浓度最大时,说明此时的溶液是碳酸钾溶液,根据碳酸钾溶液中的物料守恒可得:
离子浓度最大时,说明此时的溶液是碳酸钾溶液,根据碳酸钾溶液中的物料守恒可得:![]() ,故C正确;
,故C正确;
D.d点溶液中水电离出的![]() 离子浓度
离子浓度![]() ,溶液呈中性,
,溶液呈中性,![]() ,结合电荷守恒
,结合电荷守恒![]() ,两式相减得:
,两式相减得:![]() ,故D正确;
,故D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】下列有关水溶液的一些叙述正确的是( )
A.某水溶液中,c(H+)=![]() mol/L,该溶液呈中性
mol/L,该溶液呈中性
B.已知电离常数H2CO3的Ka1=4.2×10-7,Ka2=5.6×10-11,HClO的Ka=2.95×10-8,相同温度相同浓度溶液的pH:Na2CO3<NaClO
C.常温下,向Na2S溶液中加入NaCl溶液,S2-的水解程度不受影响
D.向含有Cl-、Br-、I-的混合溶液中滴加AgNO3溶液,先产生黄色沉淀,说明c(I-)最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家实施“青山绿水工程”,大力研究脱硝和脱硫技术。
(1)H2在催化剂作用下可将NO还原为N2。下图是该反应生成1mol水蒸气的能量变化示意图。写出该反应的热化学方程式___________。

(2)2NO(g)+O2(g)![]() 2NO2(g)的反应历程如下:
2NO2(g)的反应历程如下:
反应I:2NO(g)![]() N2O2(g)(快);H1<0 v1正=k1正·c2(NO)、v1逆=k1逆·c(N2O2);
N2O2(g)(快);H1<0 v1正=k1正·c2(NO)、v1逆=k1逆·c(N2O2);
反应Ⅱ:N2O2(g)+O2(g)![]() 2NO2(g)(慢);△H2<0 v2正=k2正·c(N2O2)·c(O2)、v2逆=k2逆·c2 (NO2);
2NO2(g)(慢);△H2<0 v2正=k2正·c(N2O2)·c(O2)、v2逆=k2逆·c2 (NO2);
①一定条件下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,平衡常数K=___________(用含k1正、k1逆、k2正、k2逆的代数式表示)。
2NO2(g)达到平衡状态,平衡常数K=___________(用含k1正、k1逆、k2正、k2逆的代数式表示)。
反应I的活化能EI___________反应Ⅱ的活化能EII(填“>”、“<”、或“=”)。
②已知反应速率常数k随温度升高而增大,则升高温度后k2正增大的倍数___________k2逆增大的倍数(填“大于”、“小于”、或“等于”)。
(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。

①装置中H+向___________池迁移。
②乙池溶液中发生反应的离子方程式:______________________。
(4)废水处理时,通H2S(或加S2-)能使某些金属离子生成极难溶的硫化物而除去。25°℃,某废液中c(Mn2+)=0.02mol·L-1,调节废液的pH使Mn2+开始沉淀为MnS时,废液中c(H2S)=0.1mol·L-1,此时pH约为___________。(已知:Ksp(MnS)=5.0×10-14,H2S的电离常数:K1=1.5×10-7,K2=6.0×10-15,1g6=0.8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.
(1)如图是1mol![]() 气体和1molCO反应生成
气体和1molCO反应生成![]() 和NO过程中能量变化示意图。则反应过程中放出的总热量应为______。
和NO过程中能量变化示意图。则反应过程中放出的总热量应为______。
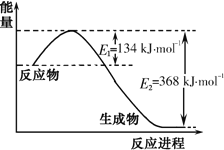
(2)在固定体积的密闭容器中,进行如下化学反应:
![]() ;
;![]() ,其平衡常数K与温度T的关系如下表:
,其平衡常数K与温度T的关系如下表:
| 298 | 398 | 498 |
平衡常数K |
|
|
|
①写出该反应的平衡常数表达式![]() ______。
______。
②试判断K1______ K2 (填写“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
③下列各项能说明该反应已达到平衡状态的是______![]() 填字母
填字母![]() .
.
![]() 容器内
容器内![]() 、
、![]() 、
、![]() 的浓度之比为1:3:2
的浓度之比为1:3:2![]()
![]() 容器内压强保持不变
容器内压强保持不变 ![]() 混合气体的密度保持不变
混合气体的密度保持不变
(3)化合物![]()
![]() 做火箭发动机的燃料时,与氧化剂
做火箭发动机的燃料时,与氧化剂![]() 反应生成
反应生成![]() 和水蒸气。某同学设计了一个
和水蒸气。某同学设计了一个![]()
![]() 空气碱性燃料电池,并用该电池电解200mL一定浓度NaCl与
空气碱性燃料电池,并用该电池电解200mL一定浓度NaCl与![]() 混合溶液,其装置如图所示:
混合溶液,其装置如图所示:
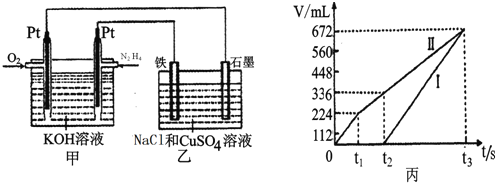
①该燃料电池的负极反应式为______;
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示![]() 气体体积已换算成标准状况下的体积
气体体积已换算成标准状况下的体积![]() ,写出在
,写出在![]() 时间段铁电极上的电极反应式______;原混合溶液中NaCl的物质的量浓度为______。
时间段铁电极上的电极反应式______;原混合溶液中NaCl的物质的量浓度为______。
③在![]() 时所得溶液的pH为______(假设溶液体积不变
时所得溶液的pH为______(假设溶液体积不变![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
__C+__K2Cr2O7+__→__CO2↑+__K2SO4+__Cr2(SO4)3+_H2O
请完成并配平上述化学方程式。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) △H1=-116 kJmol-1
CH3OH(g) △H1=-116 kJmol-1
①下列措施中有利于增大该反应的反应速率的是___;
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
②已知:CO(g)+![]() O2(g)=CO2(g) △H2=-283 kJmol-1;
O2(g)=CO2(g) △H2=-283 kJmol-1;
H2(g)+![]() O2(g)=H2O(g) △H3=-242 kJmol-1
O2(g)=H2O(g) △H3=-242 kJmol-1
则表示1 mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___;
③在容积为1 L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系。

请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是______;
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K=___。
CH3OH(g)的平衡常数K=___。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为7×10-4 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学对FeCl3与KI的反应进行探究。
(初步探究)室温下进行下表所列实验。
序号 | 操作 | 现象 |
实验Ⅰ | 取5 mL 0.1 mol·L-1 KI溶液,滴加0.1 mol·L-1FeCl3溶液5~6滴(混合溶液pH=5) | 溶液变为棕黄色 |
实验Ⅱ | 取2 mL实验Ⅰ反应后的溶液,滴加2滴0.1 mol·L-1 KSCN溶液 | 溶液呈红色 |
(1)证明实验Ⅰ中有I2生成,加入的试剂为 __________。
(2)写出实验Ⅰ反应的离子方程式:_________________。
(3)结合上述实验现象可以证明Fe3+与I-发生可逆反应,原因是_____________________。
(深入探究)20 min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(4)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:________,20 min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是_____________(写出两条)。
(5)乙同学查阅资料可知:FeCl3与KI的反应体系中还存在I- + I2![]() I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:____________。
I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:____________。
(6)丙同学针对20 min后的实验现象继续提出假设:FeCl3与KI的反应、I-与I2的反应达到平衡需要一段时间,有可能20 min之前并未达到平衡。为验证该假设,丙同学用4支试管进行实验,得到了颜色由浅到深的四个红色溶液体系,具体实验方案为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH 溶液滴加到H2X 溶液中,混合溶液的pH与 、
、 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是

A. H2X 为二元强酸
B. 当 = 1时,溶液中c(HX-)=c(H2X)
= 1时,溶液中c(HX-)=c(H2X)
C. NaHX 溶液中c(H+)-)
D. 当溶液pH=4.6 时c(HX-)>c(X2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
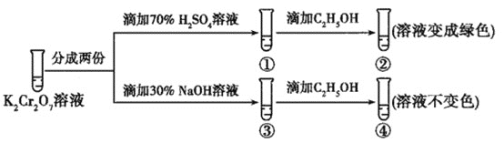
结合实验,下列说法不正确的是( )
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com