
【题目】有一种新型燃料电池,工作时在一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。现用该燃料电池和惰性电极电解Na2SO4溶液一段时间,假设电解时温度不变,下列说法不正确的是( )
A.在熔融电解质中,O2-由正极移向负极
B.通入空气的一极是正极,电极反应式为O2+4e-=2O2-
C.电解池的阳极反应式为2H2O-4e-=4H++O2↑
D.电解一共生成0.9mol气体时,理论上消耗0.1mol丁烷
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】(1)用系统命名法命名烃A:_______________________________;
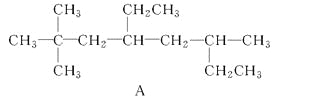
烃A的一氯代物具有不同沸点的产物有________种。
(2)有机物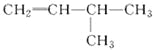 的系统名称是______________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是__________________。
的系统名称是______________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是__________________。
(3)有机物![]() 的系统名称是______________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是__________________。
的系统名称是______________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0

下列分析中正确的是
A、图Ⅱ研究的只是t0时使用催化剂对反应速率的影响
B、图Ⅰ研究的是t0时缩小容器体积对反应速率的影响
C、图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
D、图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B. [实验化学]
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。其制备原理如下:

已知:
①苯胺易被氧化;
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点 | 沸点 | 溶解度(20 ℃) |
乙酰苯胺 | 114.3℃ | 305℃ | 0.46 |
苯胺 | -6℃ | 184.4℃ | 3.4 |
醋酸 | 16.6℃ | 118℃ | 易溶 |
实验步骤如下:
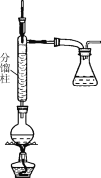
步骤1:在50 mL圆底烧瓶中,加入5 mL苯胺、7.5 mL冰醋酸及少许锌粉,依照如图装置组装仪器。
步骤2:控制温度计示数约105 ℃,小火加热回流1 h。
步骤3:趁热将反应混合物倒入盛有100 mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
(1)步骤1中加入锌粉的作用是________。
(2)步骤2中控制温度计示数约105℃的原因是________。
(3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是__________________。抽滤装置所包含的仪器除减压系统外,还有________、________(填仪器名称)。
(4)步骤3得到的粗产品需进一步提纯,该提纯方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在20.00 mL 0.1000 mol·L-1 NH3·H2O溶液中逐滴滴加0.1000 mol·L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图所示。下列说法正确的是

A. ①溶液:c(Cl-)>c(NH)>c(OH-)>c(H+)
B. ②溶液:c(NH)=c(Cl-)>c(OH-)=c(H+)
C. ①、②、③三点所示的溶液中水的电离程度②>③>①
D. 滴定过程中不可能出现:c(NH3·H2O)>c(NH)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)1 mol CO2中含有的σ键数目为________,π键数目为________。
(2)已知CO和CN-与N2结构相似,CO分子内σ键与π键个数之比为________。CH2=CHCN分子中σ键与π键数目之比为________。
(3)肼(N2H4)分子可视为NH3分子中的—个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) ΔH=-1 038.7 kJ·mol-1若该反应中有4 mol N—H键断裂,则形成的π键有________mol。
(4)Co 基态原子核外电子排布式为____________;
基态Ge原子的核外电子排布式为____________;
Zn2+的价电子轨道表示式为_______________;
Co3+核外电子未成对电子数为__________________。
(5)CH4、NH3、H2O、HF分子中共价键的极性由强到弱的顺序是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】精炼铜工业中阳极泥的综合利用具有重要意义。一种从铜阳极泥(主要含有铜、银、金、少量的镍)中分离提取多种金属元素的工艺流程如下:

已知:ⅰ分金液中含金离子主要成分为[AuCl4]-;分金渣的主要成分为AgCl;
ⅱ分银液中含银离子主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3—![]() Ag++2SO
Ag++2SO![]()
ⅲ“分铜”时各元素的浸出率如下表所示。

(1)由表中数据可知,Ni的金属性比Cu______。分铜渣中银元素的存在形式为(用化学用语表示)______。“分铜”时,如果反应温度过高,会有明显的放出气体现象,原因是_______。
(2)“分金”时,单质金发生反应的离子方程式为________。
(3)Na2SO3溶液中含硫微粒物质的量分数与pH的关系如图所示。

“沉银”时,需加入硫酸调节溶液的pH=4,分析能够析出AgCl的原因为_______。调节溶液的pH不能过低,理由为______(用离子方程式表示)。
(4)已知Ksp[Ag2SO4]=1.4×10-5,沉银时为了保证不析出Ag2SO4,应如何控制溶液中SO42—浓度(假定溶液中Ag+浓度为0.1mol/L)。________。
(5)工业上,用镍为阳极,电解0.1 mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示:
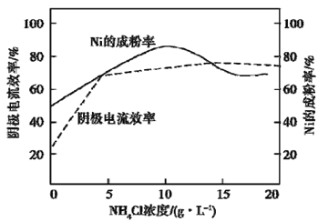
为获得髙纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为_______g/L,当NH4Cl溶液的浓度大于15g/L时,阴极有无色无味气体生成,导致阴极电流效率降低,该气体为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是 ( )
A. 稀硫酸滴在铁片上:2Fe+6H+===2Fe3++3H2↑
B. 碳酸氢钠溶液与稀盐酸混合:HCO3-+H+=H2O+CO2↑
C. 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-===Cu(OH)2↓+![]()
D. 硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-===AgCl↓+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有浓度均为0.5mol/L的四种溶液:①Na2CO3;②NaHCO3;③HCl;④NH3·H2O。
(1)上述溶液中,可发生水解的是________(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的离子方程式分别为________________, ___________
(3)向溶液④中加入少量氯化铵固体,此时![]() 的值________(填增大、减小、不变)。
的值________(填增大、减小、不变)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积___④的体积(填大于、小于、等于)
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com