
����Ŀ����������Ũ�Ⱦ�Ϊ0.5mol/L��������Һ����Na2CO3����NaHCO3����HCl����NH3��H2O��
��1��������Һ�У��ɷ���ˮ�����________(����ţ���ͬ)��
��2��������Һ�У��������������Ʒ�Ӧ�����ܺ����ᷴӦ�����ӷ���ʽ�ֱ�Ϊ________________�� ___________
��3������Һ���м��������Ȼ�粒��壬��ʱ![]() ��ֵ________(������С������)��
��ֵ________(������С������)��
��4�������ۺܵ͢���Һ��Ϻ���Һǡ�ó����ԣ�����ǰ�۵����___�ܵ����(����ڡ�С�ڡ�����)
��5��ȡ10mL��Һ�ۣ���ˮϡ�͵�500mL�������Һ����ˮ�������c(H��)��________��
���𰸡��٢� HCO3-+OH-=H2O+CO32- HCO3-+H+=H2O+ CO2 ���� С�� 1012
��������
(1)���������ӵ����ܷ���ˮ�⣬�ݴ˷�����
(2)�⼸�������У��ܺ�ǿ�ǿ�ᷴӦ������Ϊ�������ʽ�Σ��ݴ˷�����
(3)��ˮ�м����Ȼ������һˮ�ϰ����룬�ݴ˷�����
(4)NH3H2OΪ������ʣ�������ȫ���룬�ݴ˷�����
(5)ȡ10mL��Һ�ۣ���ˮϡ�͵�100mL����ҺŨ��Ϊԭ����ʮ��֮һ��Ϊ0.01mol/L���ݴ˷�����
(1)���������ӵ����ܷ���ˮ�⣬Na2CO3��NaHCO3���Ǻ��������ӵ��Σ��ܷ���ˮ�⣬�ʴ�Ϊ���٢ڣ�
(2) �⼸�������У��ܺ�ǿ�ǿ�ᷴӦ��������̼�����ƣ���Ӧ�����ӷ���ʽ�ֱ�ΪHCO3-+ OH-=H2O+ CO32-��HCO3-+H+=H2O+ CO2���ʴ�Ϊ��HCO3-+OH-=H2O+CO32-��HCO3-+H+=H2O+ CO2��
(3) ��ˮ�м����Ȼ�泥���Һ��笠�����Ũ����������һˮ�ϰ����룬����������Ũ�ȼ�С������c(NH4+)c(OH)��ֵ���ʴ�Ϊ������
(4) NH3H2OΪ������ʣ�������ȫ���룬��������ϣ���Һ�����ԣ�Ҫ������ˮӦ�������ʴ�Ϊ��С�ڣ�
(5) ȡ10mL��Һ�ۣ���ˮϡ�͵�100mL����ҺŨ��Ϊԭ����![]() ��Ϊ0.01mol/L����Kw=c(OH)c(H+)��֪��c(OH)=1012molL1�����ʱ��Һ����ˮ�������c(H+)=1012molL1���ʴ�Ϊ��1012��
��Ϊ0.01mol/L����Kw=c(OH)c(H+)��֪��c(OH)=1012molL1�����ʱ��Һ����ˮ�������c(H+)=1012molL1���ʴ�Ϊ��1012��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������ȼ�ϵ�أ�����ʱ��һ��ͨ���������һ��ͨ�붡�����壻������Dz���������(Y2O3)�������(ZrO2)���壬������״̬���ܴ���O2-�����ø�ȼ�ϵ�غͶ��Ե缫���Na2SO4��Һһ��ʱ�䣬������ʱ�¶Ȳ��䣬����˵������ȷ���ǣ� ��
A.�����ڵ�����У�O2-����������
B.ͨ�������һ�����������缫��ӦʽΪO2+4e-=2O2-
C.���ص�������ӦʽΪ2H2O-4e-=4H++O2��
D.���һ������0.9mol����ʱ������������0.1mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����һ����ѧ�x��С�鴴����һ��ͨ��������⽫��������Ϊ��ѧ�ܵ�װ�á��������ƻ��ʵ������Ͷ�������Ϳ����������֮���ǿ�ͨ��H+�Ĺ���ۺ������ʡ���ṹ��ͼ��ʾ��������˵���������
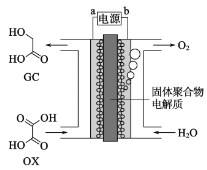
A.��Դ��b��Ϊ����
B.������ת�������У�����������H+�������������ƶ�
C.�����缫��ӦʽΪ��OX+4H++4e-=GC+H2O
D.Ϊ��ǿ�������Һ�����ԣ�����ˮ���������������NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮNa2CO3��������250mL 0.1000mol��L-1����Һ����ش�
(1)�����ƹ������õ���������______(�����)��
A.�ձ� B. ������ƽ C.������ D.��ͷ�ι� E.����ƿ
(2)��Ҫ��ˮNa2CO3������______�ˡ�
(3)����ʱ�IJ�������Һ��ӽ�����ƿ�̶���________cmʱ����__________����ͷ�ιܡ��ձ����Թܣ��ٽ�����ƿ���Ǻã��������µߵ���ҡ�ȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�����ֵ������˵����ȷ����
A.�����£�1 L pH=9��CH3COONa��Һ�У����������ˮ������Ϊ1��10-9NA
B.�����£�10 mL 5.6 mol/L FeC13��Һ�ε�100 mL��ˮ�У����ɽ�����Ϊ0.056NA
C.��Na2O2ͨ��������ˮ������������������bg���÷�Ӧת�Ƶ�����Ϊ![]()
D.6.8 g KHSO4�����к��е�������Ϊ0.15 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ܣ�CoP�����������������겣�����Ʊ����ܵij����������£�
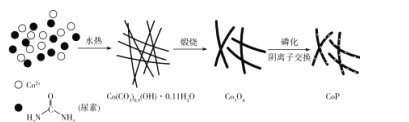
��l����̬Pԭ�ӵļ۵����Ų�ʽΪ____��Pλ��Ԫ�����ڱ���____����
��2��������Nԭ�ӵ��ӻ������� _____��C��N��O����Ԫ�صĵ�һ������������____���縺����С�����˳��Ϊ____��
��3��Co(CO3)0��5(OH����0.11H2O��CO32-��C�ļ۲���Ӷ���Ϊ____���û������в����еĻ�ѧ����_____���ţ���
A ���Ӽ� B ���ۼ� C ������ D ��λ�� E ��� F �Ǽ��Լ�
��4��һЩ��������۵����±���ʾ��
![]()
���ͱ���������֮���۵�����ԭ��____��
��5��CoP�ľ����ṹ��ͼ��ʾ�����������������ԭ�ӵľ���Ϊnpm��
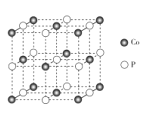
��NAΪ�����ӵ�������ֵ�����侧���ܶ�Ϊ_______-g��cm-3���г�����ʽ���ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ��FeCl3 ��Һ�����Ƶù���_________��ԭ����_____________________���������ղ�����_____________ ��ԭ���� __________________________�����ӷ���ʽ������˵������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼ�ķ���ʽ��ΪC7H8������˵����ȷ����
![]()
A. W��M��N��������ˮ�����ӳɷ�ӦB. W��M��N��һ�ȴ�����Ŀ���
C. W��M��N�����е�̼ԭ�Ӿ�����D. W��M��N����ʹ����KMnO4��Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��������ͼװ����ȡ�ܽϳ�ʱ����ڵ�Fe(OH)2������ʵ��������Һ��������������ˮ�ȼ�����С����з�����ȷ����
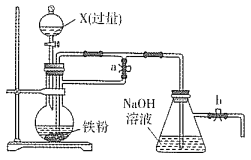
A. X������ϡ�����ϡ�����ϡ����
B. ʵ�鿪ʼʱӦ�ȹر�ֹˮ��a����b��������ƿ�м���X
C. ��Ӧһ��ʱ��������ƿ�й۲쵽��ɫ����
D. ��Ӧ���������ر�b����Һ©����������Fe(OH)2�ɽϳ�ʱ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com