
【题目】用无水Na2CO3固体配制250mL 0.1000mol·L-1的溶液。请回答:
(1)在配制过程中用到的仪器是______(填序号)。
A.烧杯 B. 托盘天平 C.玻璃棒 D.胶头滴管 E.容量瓶
(2)需要无水Na2CO3的质量______克。
(3)定容时的操作:当液面接近容量瓶刻度线________cm时改用__________(胶头滴管、烧杯、试管)再将容量瓶塞盖好,反复上下颠倒,摇匀。
科目:高中化学 来源: 题型:
【题目】B. [实验化学]
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。其制备原理如下:

已知:
①苯胺易被氧化;
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点 | 沸点 | 溶解度(20 ℃) |
乙酰苯胺 | 114.3℃ | 305℃ | 0.46 |
苯胺 | -6℃ | 184.4℃ | 3.4 |
醋酸 | 16.6℃ | 118℃ | 易溶 |
实验步骤如下:
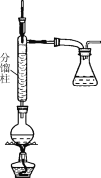
步骤1:在50 mL圆底烧瓶中,加入5 mL苯胺、7.5 mL冰醋酸及少许锌粉,依照如图装置组装仪器。
步骤2:控制温度计示数约105 ℃,小火加热回流1 h。
步骤3:趁热将反应混合物倒入盛有100 mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
(1)步骤1中加入锌粉的作用是________。
(2)步骤2中控制温度计示数约105℃的原因是________。
(3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是__________________。抽滤装置所包含的仪器除减压系统外,还有________、________(填仪器名称)。
(4)步骤3得到的粗产品需进一步提纯,该提纯方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是 ( )
A. 稀硫酸滴在铁片上:2Fe+6H+===2Fe3++3H2↑
B. 碳酸氢钠溶液与稀盐酸混合:HCO3-+H+=H2O+CO2↑
C. 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-===Cu(OH)2↓+![]()
D. 硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-===AgCl↓+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的消毒剂,可用ClO2为原料制取。某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
已知:饱和NaClO2溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时 NaClO2分解成NaClO3和NaCl。Ba(ClO2)2可溶于水。
利用图所示装置进行实验。
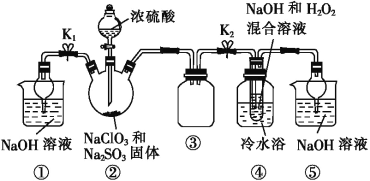
(1)装置①的作用是___________________,装置③的作用是________________。
(2)装置②中制备ClO2的化学方程式为___________________________;装置④中反应生成NaClO2的化学方程式为_____________________。
(3)从装置④反应后的溶液中获得NaClO2晶体的操作步骤为:①减压,55 ℃蒸发结晶;②趁热过滤;③__________________;④低于60 ℃干燥,得到成品。如果撤去④中的冷水浴,可能导致产品中混有的杂质是______________。
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是取少量晶体溶于蒸馏水,__________________________________________________________。
(5)为了测定NaClO2粗品的纯度,取10.0 g上述初产品溶于水配成1 L溶液,取出10 mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1的Na2S2O3标准液滴定,重复2次,平均消耗Na2S2O3溶液20.00 mL,计算得NaClO2粗品的纯度为_____。(提示:2Na2S2O3+I2=Na2S4O6+2NaI)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习小组进行如下实验。
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化)。限选试剂和仪器:0.20mol/LH2C2O4 溶液、0.010mol/L KMnO4 溶液(酸性)、蒸馏水、 试管、量筒、秒表、恒温水浴槽
(1)上述实验①②是探究 对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a 为 ;乙是实验需要测量的物理量,则表 格中“乙”应填写 。
【测定 H2C2O4·xH2O 中 x 值】 已知:M(H2C2O4)=90g/mol
称取 1.260 g 纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液。
②取 25.00 mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000 mol·L-1 的 KMnO 标准溶液进行滴定;
(2)请写出与滴定有关反应的离子方程式
(3)某学生的滴定方式(夹持部分略去)如下,最合理的是 (选填 a、b)。


(4)由右图可知消耗 KMnO4 溶液体积为 mL;
(5)滴定过程中眼睛应注视_________________;
(6)通过上述数据,求得 x= 。以标准 KMnO4 溶液滴定样品溶液的浓度,未用 标准 KMnO4 溶液润洗滴定管,引起实验结果 (偏大、偏小或没有影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有浓度均为0.5mol/L的四种溶液:①Na2CO3;②NaHCO3;③HCl;④NH3·H2O。
(1)上述溶液中,可发生水解的是________(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的离子方程式分别为________________, ___________
(3)向溶液④中加入少量氯化铵固体,此时![]() 的值________(填增大、减小、不变)。
的值________(填增大、减小、不变)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积___④的体积(填大于、小于、等于)
(5)取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出的c(H+)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铵态氮肥和草木灰混合会降低肥效的原因是____________________,CH3COO-- 和NH4+、CO32--和NH4+在溶液中都是相互__________(促进或者抑制)的双水解,但是水解程度不大,可以大量共存。
查看答案和解析>>
科目:高中化学 来源: 题型:
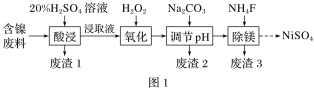
【题目】某含镍(NiO)废料中有FeO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4的工艺流程如图1所示:
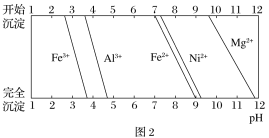
已知:①有关金属离子生成氢氧化物沉淀所需的pH如图2所示。
②25 ℃时,NH3·H2O的电离常数Kb=1.8×10-5。HF的电离常数Ka=7.2×10-4,Ksp(MgF2)=7.4×10-11。
(1)“酸浸”时,为提高浸出速率,可采取的措施有______________(写一条即可)。
(2)废渣1的主要成分是________(填化学式)。“氧化”步骤中加入H2O2的目的是____________(用离子方程式表示)。加Na2CO3调节溶液的pH至5,得到废渣2的主要成分是____________(填化学式)。
(3)25 ℃时,1 mol·L-1的NaF溶液中c(OH-)=____________(列出计算式即可) mol·L-1。NH4F溶液呈________(填“酸性”“碱性”或“中性”)。
(4)已知沉淀前溶液中c(Mg2+)=1.85×10-3mol·L-1,当除镁率达到99%时,溶液中c(F-)=________ mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com