
科目:高中化学 来源: 题型:
| ① | |||||||||||||||||
| ④ | ⑤ | ⑥ | |||||||||||||||
| ② | ③ | ⑦ | |||||||||||||||
| Fe | As | ||||||||||||||||



查看答案和解析>>
科目:高中化学 来源: 题型:
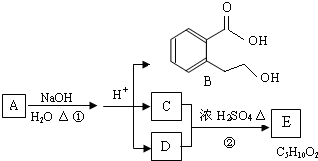
| 浓硫酸 |
| 加热 |
| 浓硫酸 |
| 加热 |


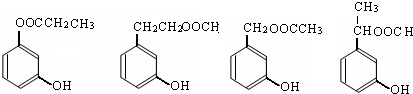 写出四者之一即可
写出四者之一即可 写出四者之一即可
写出四者之一即可| 实验编号 | C物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液的pH |
| m | 0.1 | 0.1 | pH=9 |
| n | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
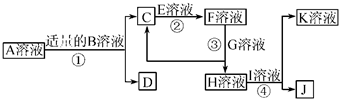 物质A~K都是由下表中的离子形成的,且为中学化学常见物质,有如图所示的转化关系.部分产物中的水已省略.(如果需要、阴、阳离子可以重复使用)
物质A~K都是由下表中的离子形成的,且为中学化学常见物质,有如图所示的转化关系.部分产物中的水已省略.(如果需要、阴、阳离子可以重复使用)| 阳离子 | Na+ Al3+ Ag+ Ba2+ | 阴离子 | OH- Cl- SO42- AlO2- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
2Na[Al(OH)4]+CO2══Na2CO3+2Al(OH)3↓+H2O
Na[Al(OH)4]+CO2══NaHCO3+Al(OH)3↓
又知,在一定条件下可实现下图所示物质之间的变化:
请填写以下空白:
(1)孔雀石的主要成分是Cu2 (OH)2CO3 (碱式碳酸铜),受热易分解,上图中的F是_________________________。
(2)明矾溶液与过量NaOH溶液反应的离子方程式是_________________________。
(3)图中所得G和D都为固体,混合后在高温下发生反应,化学方程式为__________________________________________________。
(4)分别写出B与HCl(aq)和NaOH(aq)反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
2Na[Al(OH)4]+CO2══Na2CO3+2Al(OH)3↓+H2O
Na[Al(OH)4]+CO2══NaHCO3+Al(OH)3↓
又知,在一定条件下可实现下图所示物质之间的变化: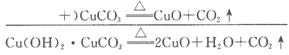
请填写以下空白:
(1)孔雀石的主要成分是Cu2 (OH)2CO3 (碱式碳酸铜),受热易分解,上图中的F是_________________________。
(2)明矾溶液与过量NaOH溶液反应的离子方程式是_________________________。
(3)图中所得G和D都为固体,混合后在高温下发生反应,化学方程式为__________________________________________________。
(4)分别写出B与HCl(aq)和NaOH(aq)反应的离子方程式:_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com