
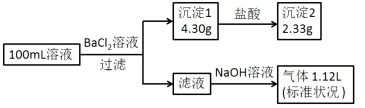
����Ŀ��ij100mL��Һ���ܺ���Na+��NH4+��Fe3+��CO32-��SO42-��Cl-�е������֣�ȡ����Һ��������ʵ�飬ʵ��������£�(�����Լ�������������ȫ���ݳ�)
����˵������ȷ����( )
A��ԭ��Һһ������CO32-��SO42-��һ��������Fe3+
B��ԭ��Һһ������Cl-�����ܴ���Na+
C��ԭ��Һ��c(Cl-)��0.1mol��L-1
D����ԭ��Һ�в�����Na+����c(Cl-)��0.1mol��L-1
���𰸡�D
��������
��������������Ȼ�����Һ�����ɳ�����һ������̼�������������е�����һ�֣���ó���ΪBaSO4��BaCO3�е�����һ�֣����������ܽ������ᣬ����һ����BaSO4��BaCO3�Ļ���һ������CO32-��SO42-�����ᱵ������2.33g�����ʵ�����![]() =0.01mol��̼������ӵ����ʵ�����
=0.01mol��̼������ӵ����ʵ�����![]() =0.01mol��̼����������Ӳ����棬һ��������Fe3+�����õ�����Һ�м����������ƣ��������壬Ϊ������һ������笠����ӣ�����Ԫ���غ㣬笠����ӵ����ʵ�����
=0.01mol��̼����������Ӳ����棬һ��������Fe3+�����õ�����Һ�м����������ƣ��������壬Ϊ������һ������笠����ӣ�����Ԫ���غ㣬笠����ӵ����ʵ�����![]() =0.05mol�����ݵ���غ㣬��������������ɵ����ʵ���֮�ͣ�0.05mol����������������ɵ����ʵ���֮��=0.01��2+0.01��2=0.04mol������һ�����������ӣ������Ӳ���ȷ����n(Cl-)��0.01mol������c(Cl-)��0.1molL-1��A��ԭ��Һһ������CO32-��SO42-��Cl-��һ��������Fe3+����A��ȷ��B��ԭ��Һһ������Cl-�����ܴ���Na+����B��ȷ��C��ԭ��Һ��c(Cl-)��0.1molL-����C��ȷ��D����ԭ��Һ�в�����Na+����c(Cl-)=0.1molL-1����D����ѡD��
=0.05mol�����ݵ���غ㣬��������������ɵ����ʵ���֮�ͣ�0.05mol����������������ɵ����ʵ���֮��=0.01��2+0.01��2=0.04mol������һ�����������ӣ������Ӳ���ȷ����n(Cl-)��0.01mol������c(Cl-)��0.1molL-1��A��ԭ��Һһ������CO32-��SO42-��Cl-��һ��������Fe3+����A��ȷ��B��ԭ��Һһ������Cl-�����ܴ���Na+����B��ȷ��C��ԭ��Һ��c(Cl-)��0.1molL-����C��ȷ��D����ԭ��Һ�в�����Na+����c(Cl-)=0.1molL-1����D����ѡD��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����������ʢ�Cu ��Һ�� ��CH3COOH ��NaHCO3 ��H2O ������NaCl ��NH3��H2O ��NH4Cl ����������ʵ��� ������ţ���
��ѧʽ | NH3��H2O | HCN | CH3COOH | H2CO3 |
����ƽ�ⳣ����25�棩 | Kb=1.77��10��5 | Ka=4.93��10��10 | Ka=1.76��10��9 | Ka1=4.30��10��7 Ka2=5.61��10��11 |
��2������ƽ�ⳣ���Ǻ���������ʵ���̶�ǿ���������ϱ��и�������������ʵĵ���ƽ�ⳣ�������п����жϣ�����ͬ�¶��£�ͬŨ�ȵ���������Һ�ĵ��������ɴ�С��˳��Ϊ ��
��3������ˮ��̶ȵ�ǿ��ͬ����������ʵĵ���̶���һ����ϵ����ϱ������ݻش��������⣺
��25��ʱ���е�Ũ�ȵ�a��NaCN��Һ b��Na2CO3��Һ c��CH3COONa��Һ��������Һ��pH�ɴ�С��˳��Ϊ ��������Һǰ��ţ�
��Ũ����ͬ��NaCN��Һ��CH3COOK��Һ��ȣ�c(Na+)��c(CN��) c(K+)��c(CH3COO��)����������������������=����
��������������ʵ���Ũ�ȵ�����Ͱ�ˮ��Ϻ���Һ�� �ԣ����������������������������������ӷ���ʽ��ʾԭ�� ��
�������£�����0.1mol��L��1�������20ml0.1mol��L��1��ˮ�У���ҺpH�������������ı仯��������ͼ��ʾ��b����ʾ��Һ�е������� ��

��NH4HCO3��Һ�� �ԣ�����������������������������
��4����ϱ������ݣ���NaCN��Һ��ͨ������CO2����������Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������þ��ͭ�Ͻ���뵽ϡ������Һ�У�����ǡ����ȫ��Ӧ�����跴Ӧ�����л�ԭ����ȫ����NO����������Һ�м������ʵ���Ũ��Ϊ3molL��1��NaOH��Һ��������ȫ��������ɳ�����������ԭ�Ͻ����������5.1g���������й���������ȷ���ǣ� ��
A����ʼ����Ͻ����������Ϊ3.6g
B���μӷ�Ӧ����������ʵ���Ϊ0.1mol
C��������ȫʱ����NaOH��Һ�����Ϊ100mL
D���ܽ�Ͻ�ʱ����NO�����Ϊ2.24L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����( )
A. ������ΪNA��CO��C2H4�����������ԼΪ22.4 L
B. ��״���£�4.48 L��ˮ(D2O)�к��е�������Ϊ2NA
C. ��MnO2��Ũ������ȡCl2ʱ��ÿ����0.5mol Cl2��ת�Ƶ�����ΪNA
D. 0.1 L 3.0 mol��L-1��NH4NO3��Һ�к���NH![]() ����ĿΪ0.3NA
����ĿΪ0.3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ִ�����з����ž�����ã����Ļ������ڹ�ũҵ���������ǵ��ճ�������Ҳ���й㷺�����á�
(1)�������ܽ⣬�����Լ������ѡ��________(��ѡ����ĸ)��
A��Ũ����B��ϡ����C��ϡ����
(2)��������(��Ҫ�ɷ���Al2O3��������SiO2��Fe2O3��)Ϊԭ�ϣ������ݶ�������Al2O3����������ͼ��ʾ��
��Al2O3�����ڵ����Al�����ʱ��������ʯ(Na3AlF6)��Ϊ���ۼ�����NaF��Al2(SO4)3��Ӧ�Ʊ�����ʯ�Ļ�ѧ����ʽΪ________________�����ʱ��ʯī���������¶�ά����950~970���������趨�ڸ�������ԭ��Ϊ________________________��
���������������ƵĻ�ѧʽ�ɱ�ʾΪ��3Na2O��3Al2O3��5SiO2��5H2O������ҺI����Ҫ�ɷ���________________���������Ʒλ���������(A/S,����ʯ��Al2O3��SiO2��������)��������ij���������A/S=10.2�����������NaOH��Һ�����������ܳ���Ϊ________________��
�������������У�����������м��������X���÷�Ӧ�����ӷ���ʽΪ________________��
(3)��(Be)����Ԫ�����ƣ�������������������������ԣ���д��BeO�����ᷴӦ�����ӷ���ʽ��Be(OH)2����NaOH��Һ�Ļ�ѧ����ʽΪ��Be(OH)2+2NaOH��Na2BeO2+2H2O����10.0mL1.00mol��L-1��Be(NO3)2��Һ����μ����Ũ�ȵ�NaOH��Һ��������������ͼ�л�����������NaOH��Һ�������ı仯ͼ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T3��ʱ����A��B��C�������ʷֱ�����100��ˮ�У��Ƴɱ�����Һ�����������ʵ��ܽ�����¶ȶ��仯��������ͼ����T3����T1�������й�˵����ȷ���ǣ� ��
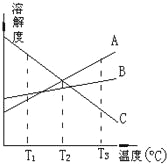
A��T3��ʱ����A�������γɵ���Һ�����ʵ���Ũ�����
B��T2��ʱ����A��C�������γɵ���Һ�����������
C��T1��ʱ����B�������γɵ���Һ�����������C����С
D�����ܽ�����߿�֪����A��C�Ļ����Һ�õ�A�ɲ��������ᾧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Դ�У���������Ⱦ��Դ���ǣ� ��
A��ú�� B������ C��̫���� D��ʯ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ӣ��������������������������ͬ���ǣ� ��
A. S2����HS�� B. H3O+��OH�� C. Na+��NH4+![]() D. K+��Ne
D. K+��Ne
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������أ����ж�Ӧ��ϵ������ǣ� ��
��ѧ���� | ʵ��Ӧ�� | |
A | Al2��SO4��3��С�մ�Ӧ | ��ĭ�������� |
B | ����ͭ������ǿ | ����ӡˢ��·�� |
C | �������ξ��������� | ��ɱ�������� |
D | �����������Ư���� | Ư��ֽ�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com