
����Ŀ����1�����������ʢ�Cu ��Һ�� ��CH3COOH ��NaHCO3 ��H2O ������NaCl ��NH3��H2O ��NH4Cl ����������ʵ��� ������ţ���
��ѧʽ | NH3��H2O | HCN | CH3COOH | H2CO3 |
����ƽ�ⳣ����25�棩 | Kb=1.77��10��5 | Ka=4.93��10��10 | Ka=1.76��10��9 | Ka1=4.30��10��7 Ka2=5.61��10��11 |
��2������ƽ�ⳣ���Ǻ���������ʵ���̶�ǿ���������ϱ��и�������������ʵĵ���ƽ�ⳣ�������п����жϣ�����ͬ�¶��£�ͬŨ�ȵ���������Һ�ĵ��������ɴ�С��˳��Ϊ ��
��3������ˮ��̶ȵ�ǿ��ͬ����������ʵĵ���̶���һ����ϵ����ϱ������ݻش��������⣺
��25��ʱ���е�Ũ�ȵ�a��NaCN��Һ b��Na2CO3��Һ c��CH3COONa��Һ��������Һ��pH�ɴ�С��˳��Ϊ ��������Һǰ��ţ�
��Ũ����ͬ��NaCN��Һ��CH3COOK��Һ��ȣ�c(Na+)��c(CN��) c(K+)��c(CH3COO��)����������������������=����
��������������ʵ���Ũ�ȵ�����Ͱ�ˮ��Ϻ���Һ�� �ԣ����������������������������������ӷ���ʽ��ʾԭ�� ��
�������£�����0.1mol��L��1�������20ml0.1mol��L��1��ˮ�У���ҺpH�������������ı仯��������ͼ��ʾ��b����ʾ��Һ�е������� ��

��NH4HCO3��Һ�� �ԣ�����������������������������
��4����ϱ������ݣ���NaCN��Һ��ͨ������CO2����������Ӧ�Ļ�ѧ����ʽ ��
���𰸡���1���ۢݢ���2��CH3COOH��H2CO3��HCN
��3����b��a��c �ڣ� ���� NH4++H2O![]() NH3��H2O+H+ ��NH3��H2O NH4Cl�ݼ�
NH3��H2O+H+ ��NH3��H2O NH4Cl�ݼ�
��4��NaCN+H2O+CO2=HCN+NaHCO3
��������
�����������Cu�ǽ������ʲ��ǵ���ʣ���Һ�����ڷǵ���ʣ���CH3COOH����������Һ�в��ֵ��룬����������ʣ���NaHCO3��������ǿ����ʣ���H2O�ܲ��ֵ���������Ӻ����������ӣ�����������ʣ�������NaCl����ȫ���룬����ǿ����ʣ���NH3H2O����Һ�в��ֵ��룬����������ʣ���NH4Cl���Σ�����Һ����ȫ���룬����ǿ����ʣ���������������ʵ����ۢݢ���
��2������ƽ�ⳣ��Խ��Խ���룬��Һ������Ũ��Խ������Խǿ��������ͬ�¶��£�ͬŨ�ȵ���������Һ�ĵ��������ɴ�С��˳��ΪCH3COOH��H2CO3��HCN��
��3������ĵ���ƽ�ⳣ��Խ��Խ���룬����Խǿ�����ε�ˮ��̶�ԽС��25��ʱ���е�Ũ�ȵ�a��NaCN��Һ��b��Na2CO3��Һ��c��CH3COONa��Һ����ˮ��̶ȣ�b��a��c��ˮ��̶�Խ����Һ�ļ���Խǿ����pHԽ����pH��b��a��c��
��Ũ����ͬ��NaCN��Һ��CH3COOK��Һ�У��ֱ���ڵ���غ�Ϊ��c��Na+��+c��H+��=c��CN-��+c��OH-����c��Na+��+c��H+��=c��CH3COO-��+c��OH-������c��Na+��-c��CN-��=c��OH-��-c��H+����c��K+��-c��CH3COO-��=c��OH-��-c��H+����NaCN����Һˮ��̶ȱ�CH3COOK����NaCN��c��OH-��������c��Na+��-c��CN-����c��K+��-c��CH3COO-����
��������������ʵ���Ũ�ȵ�����Ͱ�ˮ��Ϻ������Ȼ�泥��Ȼ������Һ��ˮ�������ԣ���ˮ������ӷ���ʽΪNH4++H2O![]() NH3��H2O+H+��
NH3��H2O+H+��
�������£�����0.1mol/L�������20mL 0.1mol/L��ˮ�У���ҺpH�������������ı仯������ͼ��ʾ��b����ʾ��ҺpH=7����֪�Ȼ����Һ�����ԣ�pH=7��˵����ҺΪ�Ȼ���백ˮ�Ļ�������Һ������ΪNH3H2O��NH4Cl��
����֪NH3H2O��Kb=1.77��10-5��H2CO3��Ka1=4.30��10-7��˵��̼��ĵ���̶�С�����γ���ʱHCO3-��ˮ��̶ȴ�����NH4HCO3��Һ�ʼ��ԣ�
��4���ɱ������ݿ�֪�����ԣ�H2CO3��HCN��HCO3-������NaCN��Һ��ͨ������CO2����������Ӧ�Ļ�ѧ����ʽ��NaCN+H2O+CO2=HCN+NaHCO3��


 �Ͻ�ƽСѧ��������ϵ�д�
�Ͻ�ƽСѧ��������ϵ�д� �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������ȷ���ǣ� ��
A. ��NA��Na+��Na2O�ܽ���1 Lˮ�У�Na+�����ʵ���Ũ��Ϊ1 molL��1
B. 100 g������Һ�����ʵ���Ũ��Ϊ18.4 molL��1����ˮϡ�͵����ʵ���Ũ��Ϊ9.2 molL��1����Ҫˮ100 g
C. ����һ�����ʵ���Ũ�ȵ��Ȼ�����Һ��ȷ��ȡһ���������Ȼ��ع��壬���뵽1000 mL������ƿ�У���ˮ1000 mL�ܽ⣬��ҡ��
D. ��10 g CuSO4�ܽ���90 gˮ�У�������������Ϊ10%��CuSO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaNO2����ۺ�ʳ�����ƣ�������ζ������ʹ����ʳ�ж�����֪NaNO2�ܷ������·�Ӧ��2NaNO2��4HI=2NO����I2��2NaI��2H2O��
(1)������Ӧ����������________________��
(2)����������Ӧ������NaNO2��NaCl����ѡ�õ������У���ʳ�ס����⻯�ص�����ֽ�������ۡ����ƣ�����Ϊ����ѡ�õ�������_______________(�����)��
(3)ij����Һ�У�����2%��5%��NaNO2��ֱ���ŷŻ������Ⱦ�������Լ���ʹNaNO2ת��Ϊ�����������Ⱦ��N2����______________(��ѡ����ĸ)��
A��NaClB��NH4ClC��HNO3 D��ŨH2SO4
(4)����ƽ���»�ѧ����ʽ��Al��NaNO3��NaOH==NaAlO2��N2����H2O������Ӧ������ת��5mole���������ɱ�״����N2�����Ϊ_______L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ת������һ��ʵ�ֵ��ǣ� ��
A��Fe2O 3��Fe(OH)3 B��CuSO4��Cu
C��CaCO3��CaO D��MgSO 4��MgCl 2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£����ڷ�Ӧ��CaCO3(��״)��2HCl===CaCl2��CO2����H2O��Ϊ�ӿ췴Ӧ���ʣ����з������е���(����)
�����������Ũ�ȡ�������ͬŨ��������������ۼ�ˮ��������CaCO3(��״)���������ݽ���״CaCO3��Ϊ��ĩ״CaCO3
A��1�� B��2�� C��3�� D��4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����֬��˵������ȷ����( )
A. ��֬��������
B. ��֬�ܶȱ�ˮС,������ˮ,�ḡ��ˮ�ϲ�.
C. ��֬û�й̶����۷е�
D. ��֬�����������µ�ˮ�ⷴӦ��Ϊ������Ӧ.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���淴ӦmA(g)ʮnB(g)![]() C(g)�ڲ�ͬ�¶ȣ�T����ѹǿ��P���£�������C�����ʵ�������x(C)�ı仯��������й��ڸ�����Ӧ��ЧӦ������ʽ��A��B��C �Ļ�ѧ���������ж��У���ȷ������ ��
C(g)�ڲ�ͬ�¶ȣ�T����ѹǿ��P���£�������C�����ʵ�������x(C)�ı仯��������й��ڸ�����Ӧ��ЧӦ������ʽ��A��B��C �Ļ�ѧ���������ж��У���ȷ������ ��

A�����ȷ�Ӧ��m+n<p B�����ȷ�Ӧ��m+n��p
C�����ȷ�Ӧ��m+n<p D�����ȷ�Ӧ��m+n��p
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨ��ʵ�������ѧ��Ӧ����ʱ�����������õ��������Ϊ(����)
A��������������ϵ��ѹǿ
B����ɫ����dz
C�����ʵ�Ũ��(������)
D��Ԫ�صĻ��ϼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij100mL��Һ���ܺ���Na+��NH4+��Fe3+��CO32-��SO42-��Cl-�е������֣�ȡ����Һ��������ʵ�飬ʵ��������£�(�����Լ�������������ȫ���ݳ�)
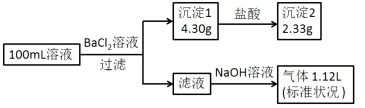
����˵������ȷ����( )
A��ԭ��Һһ������CO32-��SO42-��һ��������Fe3+
B��ԭ��Һһ������Cl-�����ܴ���Na+
C��ԭ��Һ��c(Cl-)��0.1mol��L-1
D����ԭ��Һ�в�����Na+����c(Cl-)��0.1mol��L-1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com