
【题目】金属在现代社会中发挥着巨大的作用,铝的化合物在工农业生产及人们的日常生活中也具有广泛地作用。
(1)若将铝溶解,下列试剂中最好选用________(填选项字母)。
A.浓硫酸B.稀硫酸C.稀硝酸
(2)以铝土矿(主要成分是Al2O3,杂质有SiO2、Fe2O3等)为原料,采用拜耳法生产Al2O3的流程如下图所示:
①Al2O3可用于电解制Al,电解时需加入冰晶石(Na3AlF6)作为助熔剂,用NaF和Al2(SO4)3反应制备冰晶石的化学方程式为________________;电解时用石墨作阳极,温度维持在950~970℃,阳极需定期更换,其原因为________________________。
②赤泥中铝硅酸钠的化学式可表示为:3Na2O·3Al2O3·5SiO2·5H2O,则滤液I的主要成分是________________;铝土矿的品位常用铝硅比(A/S,即矿石中Al2O3与SiO2的质量比)来衡量。某种铝土矿的A/S=10.2,则加入足量NaOH溶液后铝的理论溶出率为________________。
③该生产过程中,需向沉淀池中加入过量的X,该反应的离子方程式为________________。
(3)铍(Be)与铝元素相似,其氧化物及氢氧化物具有两性,请写出BeO与盐酸反应的离子方程式,Be(OH)2溶于NaOH溶液的化学方程式为:Be(OH)2+2NaOH=Na2BeO2+2H2O,往10.0mL1.00mol·L-1的Be(NO3)2溶液中逐滴加入等浓度的NaOH溶液,请在以下坐标图中画出沉淀量随NaOH溶液加入量的变化图:

【答案】(1)B
(2)①12NaF+Al2(SO4)3=2Na3AlF6+3Na2SO4;阳极产生的O2与石墨反应
②NaAlO2(多写NaOH也可)90%
③AlO2-+CO2+2H2O===Al(OH)3↓+HCO3-
(3)BeO+2H+=Be2++H2O;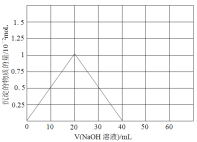
【解析】
试题分析:(1)A、C中浓硫酸、硝酸与Al反应生成有毒气体,只有B溶解Al最好,故答案为:B;
(2)①NaF和Al2(SO4)3反应可生成Na3AlF6和Na2SO4,方程式为12NaF+Al2(SO4)3=2Na3AlF6+3Na2SO4,电解时用石墨作阳极,温度维持在950~970℃,阳极产生的O2与石墨反应,因此阳极需定期更换,故答案为:12NaF+Al2(SO4)3═2Na3AlF6+3Na2SO4;阳极产生的O2与石墨反应;
②氧化铝可与氢氧化钠溶液反应生成偏铝酸钠,则溶出液的溶质主要是偏铝酸钠;由矿渣的化学式3Na2O3Al2O35SiO25H2O知,其中的n(Al2O3):n(SiO2)=3:5,故有30-3=27份的Al2O3被溶解,即Al2O3溶出,转化率为90%;故答案为:NaAlO2;90%;
③将偏铝酸钠沉淀,可以向沉淀池中通入过量的二氧化碳,反应的离子方程式为,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)BeO与盐酸反应的生成氯化铍和水,反应的离子方程式为:BeO+2H+=Be2++H2O;Be(NO3)2溶液中逐滴加入等浓度的NaOH先后发生反应:Be(NO3)2+2NaOH=Be(OH)2↓+2NaNO3,Be(OH)2+2NaOH═Na2BeO2+2H2O,先产生沉淀,然后沉淀消失,两次消耗的氢氧化钠的物质的量都为0.02mol(即20mLNaOH溶液),产生的Be(OH)2沉淀为0.01mol,沉淀量随NaOH溶液加入量的变化图为: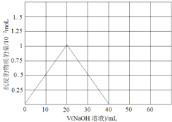 ;故答案为:BeO+2H+=Be2++H2O;
;故答案为:BeO+2H+=Be2++H2O;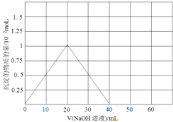 。
。


科目:高中化学 来源: 题型:
【题目】一定条件下,对于反应:CaCO3(块状)+2HCl===CaCl2+CO2↑+H2O,为加快反应速率,下列方法可行的有( )
①增加盐酸的浓度 ②增加同浓度盐酸的用量 ③加水 ④增加CaCO3(块状)的用量 ⑤将块状CaCO3改为粉末状CaCO3
A.1项 B.2项 C.3项 D.4项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述合理的是( )
A.金属材料都是导体,非金属材料都是绝缘体
B.合金的熔点比组成它的各种成分的熔点都高
C.水电站把机械能转化成电能,而核电站把化学能转化成电能
D.我国规定自2008年6月1日起,商家不得无偿提供塑料袋,目的是减少“白色污染”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医生建议因缺少某种元素而导致甲状腺肿大的病人多吃海带,这是由于海带中含有较丰富的( )
A. 碘元素 B. 铁元素 C. 钾元素 D. 锌元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A.加热
B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液
D.不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如下:(所加试剂均过量,气体全部逸出)
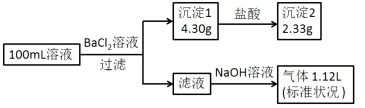
下列说法不正确的是( )
A.原溶液一定存在CO32-和SO42-,一定不存在Fe3+
B.原溶液一定存在Cl-,可能存在Na+
C.原溶液中c(Cl-)≥0.1mol·L-1
D.若原溶液中不存在Na+,则c(Cl-)<0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国的纳米基础研究能力已跻身于世界前列,例如曾作为我国两年前十大科技成果之一的就是一种合成纳米材料,其化学式为RN。已知该化合物中的Rn+核外有28个电子。则R元素位于元素周期表的( )
A. 第3周期第ⅤA族 B. 第4周期第ⅤA族
C. 第5周期第ⅢA族 D. 第4周期第ⅢA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:

已知:
①酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce3+易水解,Ce4+有较强氧化性。
②CeO2不溶于稀硫酸。
③硫酸铁铵[aFe2(SO4)3b(NH4)2SO4cH2O]广泛用于水的净化处理。
(1)在氧化环节,下列物质中最适合用作氧化剂B的是 (填序号)。
a.NaClO b.H2O2 c.KMnO4
(2)操作Ⅰ的名称是 ,检验硫酸铁铵溶液中含有NH4+的方法是 。
(3)写出反应②的化学方程式 。
(4)用滴定法测定制得的Ce(OH)4产品纯度。称取Ce(OH)4样品→加硫酸溶解→用0.1000mol/LFeSO4溶液滴定,所用FeSO4溶液在空气中露置一段时间后再进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(5)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。通过计算,该硫酸铁铵的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com