
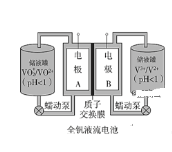
【题目】全钒液流电池是一种新型的绿色环保储能系统,工作原理如图:
离子种类 | VO2+ | VO2+ | V3+ | V2+ |
颜色 | 黄色 | 蓝色 | 绿色 | 紫色 |
(1)全钒液流电池放电时V2+发生氧化反应,该电池放电时总反应式是__________。
(2)当完成储能时,正极溶液的颜色是________
(3)质子交换膜的作用是____________
【答案】![]() 黄色 阻隔氧化剂与还原剂,使氢离子通过形成电流
黄色 阻隔氧化剂与还原剂,使氢离子通过形成电流
【解析】
(1)由工作原理图可知,反应中V2+离子被氧化,应是电源的负极,VO2+离子化合价降低,被还原,应是电源的正极反应;
(2)放电时,正极上的反应:![]() ,以此判断颜色变化;
,以此判断颜色变化;
(3)质子交换膜仅能使氢离子通过,阻隔氧化剂与还原剂;
(1)反应中V2+离子被氧化,应是电源的负极,VO2+离子化合价降低,被还原,应是电源的正极反应,反应的总方程式为![]() ,
,
故答案为:![]() ;
;
(2)放电时,正极上的反应:![]() ,生成VO2+由表中信息可知正极溶液的颜色是黄色,故答案为:黄色;
,生成VO2+由表中信息可知正极溶液的颜色是黄色,故答案为:黄色;
(3)质子交换膜仅能使氢离子通过,阻隔氧化剂与还原剂形成闭合回路,故答案为:阻隔氧化剂与还原剂,使氢离子通过形成电流。


科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是

A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:含C=C的物质(烯烃)一定条件下能与水发生加成反应,生成醇(含羟基的烃的衍生物);有机物A-D间存在图示的转化关系。下列说法不正确的是
![]()
A.D结构简式为CH3COOCH2CH3B.A能使酸性高锰酸钾溶液褪色
C.B与乙酸发生了取代反应D.可用B萃取碘水中的碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
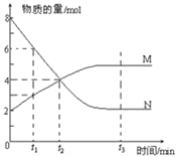
(1)该反应的化学方程式是_____________________________
(2)在图上所示的三个时刻中___________(填t1、t2或t3)时刻处于平衡状态,此时v正________v逆(填>、<或=);达到平衡状态后,平均反应速率v(N):v(M)=___________
(3)若反应容器的容积不变,则“压强不再改变”_________(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是________(选填字母) A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
(5)向一个容积为4L的密闭容器中充入7molSO2和4molO2,在一定温度和压强下,发生如下反应:2SO2(g)+O22SO3(g),经4s后达到平衡状态,测得SO2的物质的量是3mol,则以O2表示的反应速率为________;平衡时SO3的物质的量浓度________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2SiHCl3(g)= SiH2Cl2(g)+SiCl4(g) ΔH1=+48 kJ·mol-1,采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
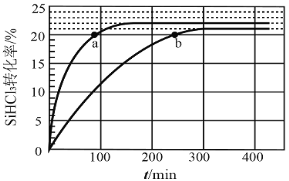
①343 K时反应的平衡转化率α=_________%。平衡常数K343 K=__________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是__________,要缩短反应达到平衡的时间,可采取的措施有_____________。
③比较a、b处反应速率大小:υa______υb(填“大于”“小于”或“等于”)。反应速率υ=υ正υ逆=![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =________(保留1位小数)。
=________(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KOH为电解质的循环阳极锌空气二次电池放电时的总反应为2Zn+O2=2ZnO,工作时,用泵将锌粉与电解液形成的浆料输入电池内部发生反应,反应所生成的产物随浆料流出电池后,被送至电池外部的电解槽中,经还原处理后再送入电池;循环阳极锌-空气二次电池工作流程图如图所示。下列说法错误的是( )
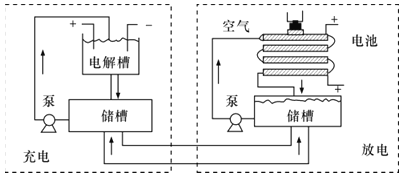
A.放电时,电池正极反应为O2+4e-+2H2O=4OH-
B.放电时,电解质中会生成少量碳酸盐
C.电池停止工作时,锌粉与电解质溶液不反应
D.充电时,电解槽阴极反应为ZnO+2e-+H2O=Zn+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E是由上述四种元素中的一种或几种组成的物质。已知A、B分子中分别含有18、10个电子,E为单质,D有漂白性。五种物质间的转化关系如图所示。下列说法错误的是( )
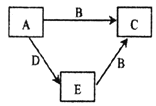
A.四种元素简单离子半径比较:W>Y>Z>X
B.Y的氢化物与Y的最高价氧化物的水化物反应生成盐
C.X、Y、W组成的化合物中一定既有离子键又有极性键
D.W是所在周期中原子半径最小的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磺酰氯(SO2Cl2)在医药、染料行业有重要用途,其熔点为-54.1 C,沸点为69.2 °C,易水解。某学习小组在实验室用SO2和Cl2在活性炭作用下制备SO2Cl2(SO2 +Cl2![]() SO2Cl2),设计如图实验(夹持装置略去)。下列说法不正确的是
SO2Cl2),设计如图实验(夹持装置略去)。下列说法不正确的是
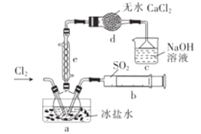
A.c中的NaOH溶液可换成NaCl溶液,效果相同
B.e中的冷却水应从下口入上口出
C.d的作用是防止水蒸气进人a中使SO2Cl2水解
D.a中冰盐水有助于SO2Cl2液化,提高SO2和Cl2的转化率.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com