
| A、该温度下,0.01 mol?L-1醋酸溶液的pH=4 |
| B、该温度下,用0.1 mol?L-1醋酸和0.01 mol/L醋酸分别完全中和等体积0.1 mol?L-1的NaOH溶液,消耗两醋酸的体积比为1:10 |
| C、该温度下,0.2 mol?L-1醋酸溶液和0.4 mol?L-1醋酸钠溶液等体积混合后,混合液的pH<4.7 |
| D、该温度下,0.2 mol?L-1盐酸溶液和0.4 mol?L-1醋酸钠溶液等体积混合后,混合液的pH>4.7 |


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
| A、1.8 g重水(D2O)中含有的质子数和电子数均为NA |
| B、常温下,16gO2和O3的混合气体中含有的氧原子数为NA |
| C、标准状况下,22.4 L NO 和22.4 L O2混合后所得气体中分子总数为1.5 NA |
| D、将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体区别于其他分散系的本质特征是有丁达尔效应 |
| B、SO3溶于水后所得溶液能导电,所以SO3是电解质 |
| C、NO2能与NaOH溶液反应,所以NO2是酸性氧化物 |
| D、SO2和Cl2都能使品红溶液褪色,但它们的漂白原理不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的电离是放热过程 |
| B、放热反应的反应速率是大于吸热反应的反应速率 |
| C、生成物总能量一定低于反应物的总能量 |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
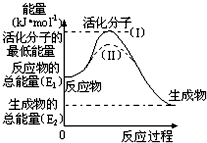 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ/mol表示.请认真观察图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ/mol表示.请认真观察图,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:
A、Na2CO3溶液中各离子浓度大小关系一定有c(Na+)>c(
| ||
| B、25℃时,Mg(OH)2固体在蒸馏水、盐酸和氯化铵溶液中的Kxp大小顺序为盐酸>氯化铵>蒸馏水 | ||
| C、已知25℃时NH4F显酸性,则25℃时的电离常数K(NH3?H2O)<K(HF) | ||
| D、AlCl3溶液和Al2(SO4)3溶液加热蒸干、灼烧都得到Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com