
【题目】两份体积相同的某植物营养液,其配方如下:

则两份营养液的成分( )
A. n(K+)相同 B. n(Cl-)相同
C. 完全相同 D. 完全不同
科目:高中化学 来源: 题型:
【题目】高温下焙烧CuFeS2的反应之一为2CuFeS2+7O2=CuSO4+CuO+Fe2O3+3SO2,下列关于该反应的叙述正确的是
A.CuFeS2中硫的化合价为-1
B.CuFeS2发生还原反应
C.1 mol CuFeS2完全反应转移13 mol电子
D.CuSO4和SO2既是氧化产物,又是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH![]() 2K2CO3+6H2O。下列说法不正确的是
2K2CO3+6H2O。下列说法不正确的是

A.甲池通入CH3OH的电极反应为CH3OH6e+2H2O![]()
![]() +8H+
+8H+
B.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体
C.反应一段时间后,向乙池中加入一定量CuCO3固体,能使CuSO4溶液恢复原浓度
D.甲池是化学能转化为电能的装置,乙、丙池是电能转化为化学能的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硫醇是巯基(–SH)和链烃基相连的含硫有机物,其性质和醇类化合物相似。某些硫醇类化合物具有葱蒜等特殊香味,常用作食用香精。
① 巯基(–SH)的电子式是________________。
② 请写出乙硫醇(C2H5SH)与钠反应的化学方程式________________。
(2)写出下列物质的结构简式
①2,3-二甲基-4-乙基己烷
_______________________________。
②支链只有一个乙基且式量最小的烷烃
______________________________________。
(3)某烃的相对分子质量为56,其中碳的质量分数为85.7%,氢的质量分数为14.3%, 则该烃的分子式是__________。该烃有多种同分异构体,其中一种能使Br2/CCl4溶液褪色且具有顺反异构。请写出其反式结构的结构简式____________________。
(4)高聚物 的单体为__________________。
的单体为__________________。
A.CH2=CH–CH2CH3 B.CH2=C(CH3)2
C.CH2=CH2 D.CH2=CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究铜与稀硝酸反应的产物及影响反应速率的主要因素,进行如下实验。
实验一 探究铜与稀硝酸反应的产物实验装置如图所示,气密性已检查。

已知:FeSO4+NO===[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显
棕色。
(1)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是___________________________________________________________。
(2)铜片和稀硝酸反应的化学方程式为____________________________________。
(3)本实验A生成的气体中,若有NO2,则B的实验现象为__________________;
若只有NO生成,则B的实验现象是_________________。
实验二 探究化学反应产物对反应速率的影响
设计如下实验,利用上图装置测定溶液突显明显棕色的时间。
序号 | 温度 | 铜片/(g) | 硝酸/mL | 硝酸铜/g |
1 | 25 ℃ | ① | ② | ③ |
2 | 25 ℃ | 5 | 20 | 0.5 |
3 | 25 ℃ | 5 | 20 | 1.0 |
(4)请将上表中实验1的实验条件填写完整。
①________,②________,③________。
(5)通过实验发现实验1、2、3的反应速率并无明显变化,为达到实验目的还需要继续进行的实验是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在pH =13的无色溶液中,可以大量共存的一组离子是
A. NH4+、K+、NO3-、CO32- B. Na+、Al3+、HCO3-、SO42-
C. Na+、Ba2+、AlO2-、NO3- D. Cu2+、K+、Br-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10﹣2,K2=5.4×10﹣5.草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水.草酸晶体(H2C2O42H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解.回答下列问题:

(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到的现象是 ,由此可知草酸晶体分解的产物中有 .装置B的主要作用是 。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验.
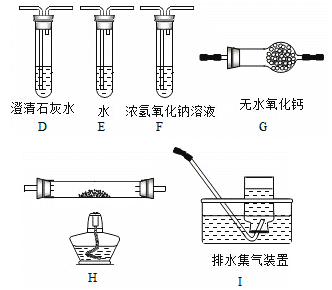
①乙组同学的实验装置中,依次连接的合理顺序为A、B、 装置H反应管中盛有的物质是 。
②能证明草酸晶体分解产物中有CO的现象是
(3)①设计实验证明:
①草酸的酸性比碳酸的强
②草酸为二元酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、常温下,将150mL 22% NaNO3溶液加100g蒸馏水后,溶液中溶质的质量分数变为14%。求原溶液的物质的量浓度________________。(小数点后保留1位)写计算过程
II、欲使100g 9.32 % 的NaOH溶液溶质的质量分数增大到20%
(1)需往溶液中加入____________克氢氧化钠?(保留小数点后2位)
(2)若20%NaOH溶液的密度为1.066 g/cm3,计算物质的量浓度__________________。(保留小数点后两位)
III.将标准状况下的HCl气体336 L溶于1.0L水中,所得盐酸密度为1.2g·cm-3,求该盐酸物质的量浓度______________________。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卢瑟福在测定原子构成时做了如下实验:取一极薄的金箔,用一高速运动的氦核射击,结果发现大多数氦核通过了金箔,极少数氦核发生偏转或被弹回.根据上述现象得出的以下结论中,正确的是( )
A. 金原子是实心球体,紧密结合排列
B. 金原子质量与氦原子核质量相当
C. 金原子带正电性
D. 相对于金原子而言,金原子核体积小、质量大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com