


| 19.2g |
| 64g/mol |
 ;NCl3遇水蒸气可生成一种常见的漂白性物质,该物质为HClO,NCl3中Cl原子结合水中的-OH,N原子结合H原子生成NH3,所以NCl3与水反应产物的化学式为 NH3和HClO.
;NCl3遇水蒸气可生成一种常见的漂白性物质,该物质为HClO,NCl3中Cl原子结合水中的-OH,N原子结合H原子生成NH3,所以NCl3与水反应产物的化学式为 NH3和HClO. ;NH3和HClO.
;NH3和HClO.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.
已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.



查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D是中学化学中常见的四种不同粒子,而且均是10电子的粒子,它们之间存在如图所示的转化关系:
已知A、B、C、D是中学化学中常见的四种不同粒子,而且均是10电子的粒子,它们之间存在如图所示的转化关系:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
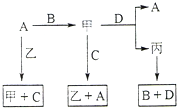 A、B、C、D 是中学化学常见的四种单质,甲、乙、丙为三种化合物,乙在常温下为无色无味的液体,各备物质间转化关系如图:(反应条件已略去),请填空:
A、B、C、D 是中学化学常见的四种单质,甲、乙、丙为三种化合物,乙在常温下为无色无味的液体,各备物质间转化关系如图:(反应条件已略去),请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
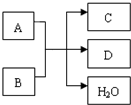 A、B、C、D是中学化学常见的物质,它们之间存在如图所示的转化关系.请按要求填空:
A、B、C、D是中学化学常见的物质,它们之间存在如图所示的转化关系.请按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:
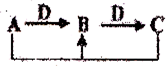 A、B、C、D是中学化学常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化关系如图,下列判断正确的是( )
A、B、C、D是中学化学常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化关系如图,下列判断正确的是( )| A、若D为H2O,A为碳,则A和C反应生成1 mol B转移的电子数为NA | ||
| B、若D为Fe,A为CI2,则B溶液蒸干后可得到纯净的B固体 | ||
| C、若D为O2,A为碱性气体,则以上转化只涉及两个氧化还原反应 | ||
D、若D为HCl,A为Na2CO3,则B溶液中c(Na+)=c(HCO3-)+2c(CO
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com