
����Ŀ�����û�ѧ��Ӧԭ����������������⣺
��1��������ˮ��Һ�д��ڵ���ƽ�⣬����0.1molL��1����ĵ���ƽ�ⳣ�����±���
���� | ����ƽ�ⳣ����25�棩 |
HClO | K=2.98��10��8 |
H2CO3 | K1=4.3��10��7 |
H2SO3 | K1=1.54��10��2 |
�ٵ������Ũ��һ��ʱ�������¶ȣ�Kֵ��������С�����䡱����
���������ӷ���ʽ���й�˵��������� ��
a��������CO2ͨ�����������Һ�У�2ClO��+H2O+CO2�T2HClO+CO32��
b��������SO2ͨ��̼������Һ�У�SO2+H2O+2CO32���T2HCO3��+SO32��
c����ͬ�¶�ʱ�������ʵ���Ũ�ȵ���������������NaOH��Һ��ȫ�к�����NaOH�����ΪV��H2CO3����V��H2SO3����V��HClO��
d����ͬ�¶�ʱ����pH��������Һ�����ʵ���Ũ�ȹ�ϵ��c��Na2CO3����c��NaClO����c��Na2SO3��
�������ᣨH2SeO3��Ҳ��һ�ֶ�Ԫ���ᣬ�н�ǿ�������ԣ�����������Һ�в���ͨ��SO2��������ɫ���ʣ�д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
��2����ҵ��ˮ�г�����һ������Cr2O72����CrO42�� �� ���Ƕ����༰��̬ϵͳ������ܴ���������д������ŷţ� ���ڷ�ˮ�д���ƽ�⣺2CrO42������ɫ��+2H+Cr2O72������ɫ��+H2O�����ı�����ʹ����ƽ�����淴Ӧ�����ƶ���������˵����ȷ���� ��
a��ƽ�ⳣ��Kֵ���Բ��ı�
b���ﵽ��ƽ��CrO42�����������ʵ���Cr2O72������������
c���ﵽ��ƽ�����ҺpHһ������
d���ٴ�ƽ��ǰ�淴Ӧ����һ����������Ӧ����
��Cr2O72����CrO42���������ɵ�Cr��OH��3����Һ�д������³����ܽ�ƽ�⣺Cr��OH��3��s��Cr3+��aq��+3OH����aq����������Cr��OH��3��Ksp=10��32 �� ��c��Cr3+������10��3 molL��1 �� ��Һ��pH����4ʱ������С���û�С�������������
��3����֪����2CH3OH��g��CH3OCH3��g��+H2O��g�� ��CO��g��+2H2��g��CH3OH��g��
��CO��g��+H2O��g�� CO2��g��+H2��g��
ij�¶���������Ӧ��ƽ�ⳣ����ֵ����ΪK1��K2��K3 �� ����¶��·�Ӧ3CO��g��+3H2��g��CH3OCH3��g��+CO2��g���Ļ�ѧƽ�ⳣ��K=���ú�K1��K2��K3�Ĵ���ʽ��ʾ������ij�̶�������ܱ������м���3mol CO��3mol H2 �� ��ַ�Ӧ��ָ���ԭ�¶ȣ��ⶨ������ѹǿΪ��Ӧǰ�� ![]() ����CO��ת����Ϊ ��
����CO��ת����Ϊ ��
���𰸡�
��1������ac��H2SeO3+2SO2+H2O=Se��+2H2SO4
��2��ad��û��
��3��K1K22K3��75%
���������⣺��1��������ĵ���Ϊ���ȹ��̣����ȴٽ����룬ƽ�ⳣ���������¶ȣ�ƽ�ⳣ����С�����Դ��ǣ���С�����ɱ������ݿ�֪����H2SO3��H2CO3��HSO3����HClO��HCO3�� �� a��������CO2ͨ�����������Һ��Ӧ����HCO3�� �� ��Ӧ�����ӷ���ʽΪClO��+H2O+CO2=HClO+HCO3�� �� ��a����b��������SO2ͨ��̼������Һ������HCO3����SO32�� �� ���ӷ���ʽΪSO2+H2O+2CO32��=2HCO3��+SO32�� �� ��b��ȷ��c����ͬ�¶�ʱ�������ʵ�����������������NaOH��Һ��ȫ�кͣ���̼�ᡢ�����ᶼΪ��Ԫ�ᣬ������NaOH�����Ϊ��V��H2CO3��=V��H2SO3����V��HClO������c����d���ζ�Ӧ���������Խ������ˮ��̶�Խ����ͬ�¶�ʱ����pHʱ����ҺŨ��ԽС������������Һ�����ʵ���Ũ�ȹ�ϵ��c��Na2CO3����c��NaClO����c��Na2SO3������d��ȷ�����Դ��ǣ�ac��������������Һ�в���ͨ��SO2��������ɫ���ʣ�Ӧ����Se��˵�������������������������ԭ��Ӧ���������Se������ʽΪH2SeO3+2SO2+H2O=Se��+2H2SO4 �� ���Դ��ǣ�H2SeO3+2SO2+H2O=Se��+2H2SO4����2����a�����¶Ȳ��䣬��ƽ�ⳣ��Kֵ���Բ��ı䣬��a��ȷ��b�������ʹ�ϵ�Լ���������֪�ﵽ��ƽ��CrO42�����������ʵ���Cr2O72�����������ʵ�2������b����c����������Һ������Ũ�ȣ���ƽ�������ƶ���ƽ���ƶ���ﵽ��ƽ����ҺpHһ����С����c����d��ƽ��ʱ���淴Ӧ������ȣ�ƽ�������ƶ������ٴ�ƽ��ǰ����Ӧ����һ�������淴Ӧ���ʣ���d��ȷ�����Դ��ǣ�ad���ڵ�c��Cr3+������10��3 molL��1 �� ��Һ��pH����4ʱ��c��OH����=10��10mol/L��c��Cr3+��c3��OH����=10��33��10��32 �� û�г������ɣ����Դ��ǣ�û�У���3���ɸ�˹���ɿ�֪����Ӧ�١�2+��Ӧ��+��Ӧ����ӵ��ܷ��̣����ܷ��̵�ƽ�ⳣ�����ڷַ��̵�ƽ�ⳣ��֮������K=K12K2K3 ��
3CO��g��+ | 3H2��g�� | CH3OCH3��g��+ | CO2��g�� | |
��ʼ��mol�� | 3 | 3 | X | X |
ת����mol�� | X | X |
|
|
ƽ�⣨mol�� | 3-x | 3-x |
|
|
������ѹǿΪ��Ӧǰ�� ![]() ����
���� ![]() =
= ![]() ��
��
x=2.25��
��CO��ת����Ϊ ![]() ��100%=75%��
��100%=75%��
���Դ��ǣ�K1K22K3��75%��
�����㾫����ͨ��������û�ѧƽ��״̬���ʼ������ͻ�ѧƽ��ļ��㣬���ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ��������������淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч������Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%�����Խ����⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ����С���о���������������ʱ���ı�ijһ�����Ի�ѧƽ���Ӱ�죬�õ����±仯���ɣ�ͼ��P��ʾѹǿ��T��ʾ�¶ȣ�n��ʾ���ʵ������� �� 
A.��Ӧ��H��0��P2��P1
B.��Ӧ��H��0��T1��T2
C.��Ӧ��H��0��T2��T1�����H��0��T2��T1
D.��Ӧ������H��0��T2��T1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���Һ����ˮ���������c��OH����=1��10��14molL��1���������������Һ��һ���ܴ����������������
A. Al3+ Na+ CO32�� Cl�� B. K+ Ba2+ Cl�� NO3��
C. K+ Na+ Cl�� CO32�� D. K+ NH4+ SO42�� NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���穁Fenton��������ˮ�����л���Ⱦ�オ��ĸ������������䷴Ӧԭ����ͼ��ʾ�����е�������H2O2��Fe2+����Fenton��Ӧ��Fe2++H2O2=Fe3++OH��+OH�����ɵ��������ɻ���OH�������������л���Ⱦ�����˵������ȷ���ǣ� �� 
A.��Դ��A���Ǹ���
B.������ֻ��O2��Fe3+������ԭ��Ӧ
C.�����Ϸ����缫��Ӧ��H2O��e��=OH+H+ ��
D.����1molO2 �� ���Բ���4molOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊ���ϰ�ȫҪ�����( )
A. ���������ľƾ���ʵ��̨���Ż�ʱ�� ������ˮ����
B. �������Ż�ʱ�� ������ʪë������
C. ��������й©ʱ�� Ѹ���뿪�ֳ���������ߴ�����
D. ϡ��Ũ����ʱ�� ��ˮ����Ũ�����в����Ͻ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л��ﺬ��C��H��O��N����Ԫ�أ���ͼ�Ǹ��л�������ģ�ͣ�
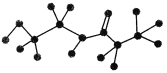
(1)���л���ķ���ʽΪ________���ṹ��ʽΪ__________________��
(2)���л�����ܷ����ķ�Ӧ��________(����)��
��ȡ����Ӧ ����ȥ��Ӧ �ۼӾ۷�Ӧ ��������Ӧ ��������Ӧ �����۷�Ӧ
(3)���л����ˮ�ⷴӦ�Ļ�ѧ����ʽΪ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���NH4+��NH3��NH2����������˵������ȷ���ǣ� ��
A.�����������еĵ��������
B.�������е�ԭ�ӵ��ӻ���ʽ��ͬ
C.�������Ŀռ乹����ͬ
D.���Ǵ�С��ϵ��NH4+��NH3��NH2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҴӺ����Һ����H2O�⣬����CCl4��I2��I���ȣ��л��յ⣬��ʵ�������ͼ1�� 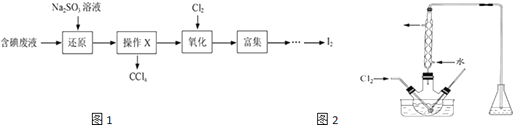
��1�����Һ�м����Թ�����Na2SO3��Һ������Һ�е�I2��ԭΪI�� �� �����ӷ���ʽΪ�ò�����I2��ԭΪI����Ŀ���� ��
��2������X������Ϊ ��
��3������ʱ��������ƿ�н���I����ˮ��Һ���������pHԼΪ2������ͨ��Cl2 �� ��400C���ҷ�Ӧ��ʵ��װ����ͼ2��ʾ����ʵ������ڽϵ��¶��½��е�ԭ��������ƿ��ʢ����Һ���õ�Ϊ ��
��4����֪��5SO32��+2IO3��+2H+�TI2+5SO42��+H2O ij�����ˮ��pHԼΪ8����һ������I2 �� ���ܴ���I����IO3���е�һ�ֻ����֣��벹���������麬���ˮ���Ƿ���I����IO3����ʵ�鷽����ȡ���������ˮ��CCl4�����ȡ����Һ��ֱ��ˮ���õ�����Һ���鲻���ⵥ�ʴ��ڣ�֤����ˮ�к���I���ķ�������֤����ˮ�к���IO3���ķ����� �� ��ʵ���пɹ�ѡ����Լ���ϡ���ᡢ������Һ��FeCl3��Һ��Na2SO3��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������,��������Һ�п��Դ����������( )
A.K+��Na+��HCO3-��Cl-B.Na+��Al3+��SO42-��NO3-
C.NH4+��K+��OH-��SO42-D.Ba2+��Na+��NO3-��CO32-
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com