
【题目】某小组在20℃,101KPa下探究Cl2在蒸馏水和饱和食盐水中的溶解性。如图I、II所示,该小组用两支100mL注射器均吸入40mLCl2,然后分别吸入20mL蒸馏水和饱和食盐水,夹紧止水夹,充分振荡。下列说法正确的是( )
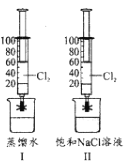
A.图I注射器中c(Cl-)约为0.09molL-1
B.图l注射器中n(ClO-)小于图II
C.图II注射器的活塞移动到20mL刻度处
D.图II注射器中存在NaCl(s)![]() Na+(aq)+Cl-(aq)
Na+(aq)+Cl-(aq)
【答案】D
【解析】
用两支100mL注射器均吸入40mL Cl2,然后分别吸入20mL蒸馏水和饱和食盐水,夹紧止水夹,充分振荡,氯气和水反应生成盐酸和次氯酸,形成化学平衡,Cl2+H2OH++Cl-+HClO,饱和氯化钠溶液中氯离子浓度大,化学平衡逆向进行,氯气溶解度减小;饱和氯化钠溶液中通入氯气,存在溶解结晶平衡状态,NaCl(s)Na+(aq)+Cl-(aq),据此分析判断。
A.常温常压下PV=nRT,饱和氯水中氯气的总浓度为: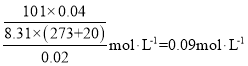 ,故A错误;
,故A错误;
B.饱和食盐水中氯气溶解度减小,图Ⅰ注射器中n(ClO)大于图Ⅱ,故B错误;
C.图Ⅱ中饱和食盐水中氯气溶解度减小,氯气不能全部吸收,注射器的活塞不能移动到20mL刻度处,故C错误;
D.氯气和水反应生成盐酸和次氯酸,形成化学平衡:Cl2+H2OH++Cl+HClO,饱和氯化钠溶液中氯离子浓度大,化学平衡逆向进行,氯气溶解度减小;饱和氯化钠溶液中通入氯气,存在溶解结晶平衡状态:NaCl(s)Na+(aq)+Cl(aq),图Ⅱ注射器中存在NaCl(s)Na+(aq)+Cl(aq),故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】某课外活动小组收集了一种合金进行以下探究(已知铜元素的焰色反应呈绿色)。
(1)外观暗灰色,表皮光滑;
(2)在酒精灯外焰上灼烧,火焰呈绿色,合金片熔化,但不滴落;
(3)取刮去表皮的合金10 g,放入足量的稀硫酸中,收集到标准状况下的H2 8.96 L;
(4)另取刮去表皮的合金10 g,放入足量的NaOH溶液中,也收集到标准状况下的H2 8.96 L。
试据此判断,该合金中一定含有的元素是________(写元素符号);可能含有的元素是________(填选项编号)。
a.Ag b.Mg
c.Na d.Fe
如果该合金中只含2种元素,则二者的质量比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢溴酸在医药和石化工业上有广泛的用途。下图是工业制备氢溴酸粗品并精制的流程:(沸点:Br2:58.5℃;HBr:-66.8℃;H2SO4:338℃)

(1)混合①中反应的离子方程式是__________________________________。
(2)混合①中不直接用水而使用冰水的目的是________________________。
(3)操作b适用于______混合物的分离(填序号)。
A.固体和液体 B.固体和固体 C.互不相溶的液体 D.互溶的液体
(4)混合②中加入亚硫酸钠的目的是__________________。
(5)纯净的氢溴酸应为无色液体,但工业生产中制得的氢溴酸(工业氢溴酸)常带有黄色,甲同学猜测可能是含有Fe3+,乙同学猜测可能是含有Br2。请写出证实乙同学猜想的实验方法是________________________。
(6)若起始使用m kg溴单质作原料,完成生产后,得到精制氢溴酸溶液250 L。取2.5 mL精制溶液稀释,在稀释液中加入足量的硝酸银溶液充分反应,若充分反应后得到n g淡黄色沉淀,则单质溴的利用率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据SO2通入不同溶液中的实验现象,所得结论不正确的是( )
溶液 | 现象 | 结论 | |
A | 含HCl,BaCl2的FeCl3溶液 | 产生白色沉淀 | SO2是酸性氧化物 |
B | H2S溶液 | 产生黄色沉淀 | SO2有氧化性 |
C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有还原性 |
D | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠、碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:____。
(2)在钠、碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是_____。
(3)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)变化关系如表:
n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 1∶91 |
pH | 8.2 | 7.2 | 6.2 |
上表判断NaHSO3溶液显___性,用化学平衡原理解释:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯环中不存在碳碳单键和碳碳双键交替的结构,可以作为证据的事实是( )
①苯是无色易挥发的液体;
②苯不能使酸性高锰酸钾溶液褪色;
③![]() 和
和 是同一种物质。
是同一种物质。
A. ①②③ B. ①和② C. ①和③ D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
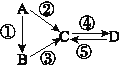
(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的2个用途:__________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:________________。
(3)若D物质具有两性,②、③反应均要用强碱溶液。如④反应时通入过量的一种引起温室效应的主要气体,写出该气体的电子式:_________,A的元素在周期表中的位置:__________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式:_____________________。D的化学式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 4种短周期元素的原子序数依次增大。A、D同族;B、C同周期。A、B组成的化合物甲为气态,其中A、B原子个数之比为4:1。常温下,由A、C组成的两种化合物乙和丙都为液态,乙中A、C原子个数比为1:1;丙中A、C原子个数比为2:1。由D和C组成的两种化合物丁和戊都为固态,丁中D、C原子个数之比为1:1;戊中D、C个数比为2:1。B元素的最高价氧化物跟丁能发生化学反应,生成物为两种,其中一种为C的单质。
(1)写出对应物质的化学式①乙_______;②丁_______。
(2)B元素的最高价氧化物跟丁反应的化学方程式_______。
(3)写出下列物质的电子式①甲_______;②戊_______。
(4)A、B、C、D4种原子的半径由大到小顺序______(填元素符号)。
(5)由A、B、C、D4种原子组成的既含离子键又含共价键的物质的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知a、b、c的分子式均为C9H10O2,结构简式如图所示。下列说法正确的是( )
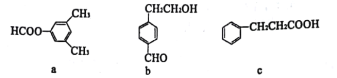
A.a、b、c都能与Na反应产生H2
B.a、b、c分子中所有碳原子可能共平面
C.b与c在浓硫酸加热条件下可以发生缩聚反应
D.c苯环上的一氯代物和二氯代物分别为3种和4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com