
【题目】下列实验设计方案一定可行的是( )
A.用水鉴别苯和四氯化碳
B.用降温结晶的方法除去KNO3中混有少量的NaCl
C.用分液的方法分离碘的四氯化碳溶液
D.用酒精萃取碘水中的碘
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】硫及其化合物在生产生活中应用广泛。回答下列问题:
(1)铁铵矾是一种化学物质,分子式是 NH4Fe(SO4)2·12H2O,其溶于水后,溶液中的离子浓度大小关系为__________________。
(2)已知某溶液中含有 CO32-、SO42-等离子,取一定量的该溶液,向其中滴加BaCl2溶液,当 CO32-开始沉 淀时,溶液中c(CO32-)/c(SO42-)为_______________。(已知 Ksp(BaSO4 )=1.0×10-10 ,Ksp(BaCO3)=2.5×10-9 )
(3)已知:S2Cl2(l)+Cl2(g)=2SCl2(l) ΔH=-50.2kJ·mol-1 。断裂 1molCl-Cl键、1molS-S键分别需要吸收 243kJ、268kJ 的能量,则断裂 1mol S-Cl键需要吸收的能量为____kJ。
(4)用 NaOH 溶液吸收烟气中的 SO2,将所得的 Na2SO3 溶液进行电解,可以制备H2SO4,其原理如下图所示(电极材料为石墨)。
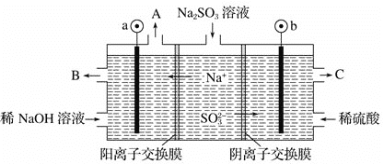
阳极的电极反应式为______________________;其中可循环使用的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在溶液中大量共存的是
A.H+、Ca2+、Cl-、CO32-B.I-、ClO-、K+、H+
C.Na+、Fe3+、SO42-、OH- D.Na+、Cu2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产生活中所采取的措施不能用化学反应速率解释的是
A.有些食物的标签上注明须冷藏B.在糕点制作过程中添加防腐剂
C.在轮胎制品中加入适量的炭黑D.燃煤发电时常用煤粉代替煤块
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01. | 0.008 | 0.007 | 0.007 | 0.007 |
(1)已知:K300℃>K350℃,写出该反应的平衡常数表达式:K=_________________,关于该反应的下列说法中,正确的是________。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)下图中表示NO2的变化的曲线是____________________,用O2表示从0-2s内该反应的平均速率v=_______________。
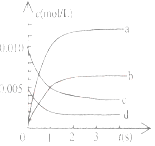
(3)能说明该反应已达到平衡状态的是__________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v (NO)=2v(O2) D.容器内密度保持不变
(4)下列措施中能使n(NO2)/n(NO)增大的有____。(填字母)
A.升高温度 B.加入催化剂
C.不断充入O2 D.充入He(g),使体系总压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下:Ksp(AgCl)=1.6×10-10,下列叙述正确的是 ( )
A.AgCl在饱和NaCl溶液中的Ksp比在纯水中的小
B.AgCl的悬浊液中c(Cl-)=4×10-5.5mol/L
C.将0.001 mol·L-1AgNO3溶液滴入0.001 mol·L-1的KCl,无沉淀析出
D.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.1mol/L、体积为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg(V/ V0)的变化关系如图所示。下列叙述正确的是( )

A. HX、HY都是弱酸,且HX的酸性比HY的弱
B. 相同温度下,电离常数K(HX):a>b
C. 常温下,由水电离出的c(H+)·c(OH-):a<b
D. lg(V/ V0)=3,若同时微热两种溶液,则[c(X-)/c(Y-)]减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物(如图)是农药生产中的一种中间体,其结构简式如下。下列叙述正确的是
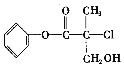
A. 该有机物属于芳香烃
B. 该有机物可以和Br2的CCl4溶液发生加成反应
C. 该有机物和浓硫酸混合加热,可能发生消去反应
D. 1mol该有机物和足量的NaOH溶液反应,最多可与3mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在_________(填编号字母)称量。
A、小烧杯中 B、洁净纸片上 C、托盘上
(2)滴定时,用0.2000 mol/L的盐酸标准液来滴定待测溶液,可选用_______(填编号字母)作指示剂。
A、甲基橙 B、石蕊 C、酚酞
(3)滴定过程中,眼睛应注视_______________________________,若用酚酞做指示剂,滴定终点的标志是_____________________________________________。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是________mol/L,烧碱样品的纯度是_____________。
滴定 次数 | 待测溶液 体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(5)若未用待测液润洗盛放标准盐酸的滴定管,则可使测定结果______(“偏高”“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com