
Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药等。某生产BaCO3、BaSO4的化工厂生产中排出大量的钡泥[主要含有BaCO3、BaSO3、Ba(FeO2)2等],该厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下:
已知: ①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9。
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式说明提纯原理: 。
(2)酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为 。
(3)该厂结合本厂实际,选用的X为 (填序号),中和I使溶液中的 (填离子符号)的浓度减小。
| A.BaCl2 | B.Ba(OH)2 | C.Ba(NO3)2 | D.BaCO3 |
(16分)
(1)BaSO4(s)+CO32- BaCO3(s)+SO42-(3分)
BaCO3(s)+SO42-(3分)
(2)Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O(3分)
(3)D(2分) Fe3+、H+(2分)
(4)BaSO4、Fe(OH)3(3分)
(5) ×100%(3分)
×100%(3分)
解析试题分析:(1)根据已知信息可知,5.1×10-9约为1.1×10-10的46倍,虽然Ksp(BaCO3)> Ksp(BaSO4),因此BaSO4可以转化为BaCO3,前提是增大碳酸根离子的浓度,使碳酸根离子与钡离子结合生成碳酸钡沉淀,导致BaSO4 (s) Ba2++SO42-的平衡向右移动,总反应为BaSO4(s)+CO32-
Ba2++SO42-的平衡向右移动,总反应为BaSO4(s)+CO32- BaCO3(s)+SO42-;
BaCO3(s)+SO42-;
(2)依题意推断,酸溶时Ba(FeO2)2与HNO3反应生成的两种硝酸盐分别是硝酸钡、硝酸铁,不涉及氧化还原反应,利用观察法可以配平该复分解反应方程式,即Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)氯化钡不能与氢离子反应,不能调节pH,且引入氯离子,故A选项错误;氢氧化钡与氢离子能反应,可以调节溶液pH,但是氢氧化钡是强碱,成本高,且容易导致溶液pH升高过快,超出中和I要求的pH范围,故B选项错误;硝酸钡不能与氢离子反应,故C选项错误;碳酸钡与氢离子能反应,生成钡离子、二氧化碳气体和水,既能调节溶液pH在4~5之间,又不引入新的杂质,故D选项正确;根据已知信息推导,硝酸是氧化性酸,钡泥酸浸之后溶液中无亚铁离子,加入碳酸钡溶液pH在4~5之间,既能减小氢离子溶液,又能促进铁离子完全水解,导致铁离子完全变为氢氧化铁沉淀,则中和I使溶液中的氢离子和铁离子的浓度减小;
(4)由于硝酸是强酸、强氧化性酸,则BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O、3BaSO3+2HNO3=3BaSO4+2NO↑+H2O,Ba(OH)2+2HNO3= Ba(NO3)2+2H2O,则最后的废渣中除原有的难溶性杂质外,还含有BaSO4、Fe(OH)3;(5)由于硫酸钡的式量为233,n=m/M,则硫酸钡的物质的量为m2/233 mol;由于反应Ba(NO3)2+H2SO4= BaSO4↓+2HNO3中Ba(NO3)2与BaSO4的系数之比等于物质的量之比,则晶体中Ba(NO3)2的物质的量为m2/233 mol;由于硝酸钡的式量为261,m=n?M,则晶体中硝酸钡的质量为261 m2/233g;由于晶体的质量为m1g,则晶体中硝酸钡的纯度计算表达式为261m2/233m1×100%。
考点:考查物质制备化学工艺流程,涉及沉淀的转化原理、复分解反应方程式、除杂试剂的选择、除杂的原理、滤渣的主要成分、物质的量在化学方程式中的应用、质量、摩尔质量、纯度等。


科目:高中化学 来源: 题型:计算题
某温度下,纯水电离出的c(H+)=2×10—7mol/L。
(1)该温度下,0.1mol/L 盐酸的PH= ,0.1mol/L NaOH溶液中的c(H+)=
(2)该温度下,pH=13的NaOH溶液中的c(OH—)是pH=11的NaOH溶液中的c (OH—)的 倍,若将两者以等体积混合,所得溶液pH值为 。(lg2=0.3,lg3=0.5,lg5=0.7)
(3)该温度下,等物质的量浓度的NaOH溶液与盐酸按3∶2体积比混合(不考虑混合时的体积变化),所得溶液的pH值为12,它们的浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验测定酸碱中和滴定曲线是高中化学的重要定量实验。下表是用0.10 mol/L的盐酸滴定 0.10 mol/L 20.00 mL NaOH 溶液时获得的一些相关数据。请回答下列问题:
(1)填写表中①②对应的 pH (结果保留两位小数)
(2)下图是本实验的滴定曲线图。请根据该图,说明强酸溶液滴定强碱溶液时,为什么既可以使用甲基橙作为指示剂,又可以使用酚酞试液作指示剂来指示滴定终点?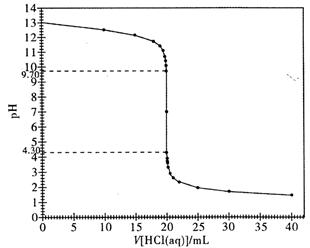
(3)若在滴定终点时俯视读数,最终测得的氢氧化钠溶液的浓度会 (填“偏大”、“偏小”或“没有影响”,下同);若滴定结束时,滴定管尖嘴悬有半滴标准盐酸,最终测得的氢氧化钠溶液的浓度会;若盛装待测液的锥形瓶洗涤干净后,未干燥即盛装待测液,最终测得的氢氧化钠溶液的浓度会 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
从含镁、钾盐湖水中蒸发最后得到的产物中含光卤石(xKCl·yMgCl2·zH2O),它在空气中极易潮解、易溶于水,是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定:①准确称取5. 550g样品溶于水,配成l00mL溶液。②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0. 580g。③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305g。
(1)步骤②中检验白色固体已洗净的方法是 。
(2)已知某温度下Mg( OH)2的Ksp ="6.4" xl0-12,当溶液中c(Mg2+)≤1.0×10 -5mol·L-1可视为沉淀完全,则应保持溶液中c(OH-)≥ mol·L-1。
(3)通过计算确定样品的组成(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
酸碱中和滴定是应用最多的滴定。现在以酚酞为指示剂,用已知浓度的NaOH溶液去滴定一定体积、未知浓度的HCl溶液。
(1)在滴定中,若实验操作不当会导致实验误差。下列操作会使实验结果偏高的是 。
①酸式滴定管洗涤后没有用待测液润洗
②碱式滴定管洗涤后没有用标准液润洗
③在滴定过程中,向锥形瓶中添加蒸馏水
④待测液从锥形瓶中溅出
⑤滴定过程中起始读数时俯视,终点后读数时仰视
(2)在滴定管使用时首先应该进行的操作是_______________________,滴定过程中左手控制滴定管,右手旋摇锥形瓶,眼睛注视锥形瓶中溶液颜色变化,达到滴定终点的现象是:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b>d。符合上述实验结果的盐溶液是( )
| 选项 | X | Y |
| A. | AgNO3 | Cu(NO3)2 |
| B. | MgSO4 | CuSO4 |
| C. | FeSO4 | Al2 (SO4)3 |
| D. | CuSO4 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
结合下图判断,下列叙述正确的是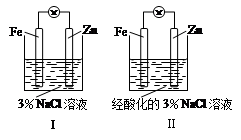
| A.Ⅰ和Ⅱ中正极均被保护 |
| B.Ⅰ和Ⅱ中负极反应均是:Fe-2e-===Fe2+ |
| C.Ⅰ正极反应是:O2 + 2H2O + 4e-===4OH- |
| D.Ⅰ和Ⅱ中分别加入少量KSCN溶液,溶液均变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是
| A.由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-===AlO2-+2H2O |
| C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-===Cu2+ |
| D.由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。对该电池的描述合理的是①溶液中硫酸的物质的量浓度保持不变;②Cu极上有气泡产生,发生还原反应;③Cu为负极,Zn为正极;④原电池在工作时电子由负极通过溶液流向正极;⑤该装置将化学能转变为电能( )
| A.④⑤ | B.③⑤ | C.①② | D.②⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com