
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b>d。符合上述实验结果的盐溶液是( )
| 选项 | X | Y |
| A. | AgNO3 | Cu(NO3)2 |
| B. | MgSO4 | CuSO4 |
| C. | FeSO4 | Al2 (SO4)3 |
| D. | CuSO4 | AgNO3 |
A
解析试题分析:装置图分析电极名称a为阳极,b为阴极,c为阳极,d为阴极,结合电解原理,溶液中离子放电顺序分析判断电极反应,电极b和d上没有气体逸出,但质量均增大,说明阴极上溶液中金属离子在阴极析出金属单质;A、X为AgNO3,阴极电极反应为溶液中银离子放电,电极反应为:Ag++e-=Ag,Y为Cu(NO3)2 ,阴极上溶液中铜离子放电,金属铜析出,电极反应Cu2++2e-=Cu,依据电子守恒Cu~2Ag,增重b>d,故A正确;B、X为MgSO4,阴极电极反应为溶液中氢离子放电,无金属析出;Y为CuSO4 ,溶液中阴极上铜离子得到电子析出金属,故B错误;C、X为FeSO4,阴极是溶液中氢离子得到电子生成氢气,无金属析出,Y为Al2 (SO4)3,阴极上是氢离子放电无金属析出,故C错误;D、X为CuSO4,阴极是溶液中铜离子析出,电极反应Cu2++2e-=Cu,Y为AgNO3,阴极电极反应为溶液中银离子放电,电极反应为:Ag++e-=Ag,依据电子守恒Cu~2Ag,增重d>b,不符合题意,故D错误,故选A。
考点:考查电解原理的分析应用,主要是电极反应,溶液中离子浓度放电顺序的判断,电极反应书写方法和电子守恒的计算应用


科目:高中化学 来源: 题型:计算题
在一定温度下,测得0.1 mol·L-1CH3COOH溶液的PH为3.0。则CH3COOH在水中的电离度为 ,此温度CH3COOH的电离平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液?称量时,样品可放
在________(填编号字母)称量?
A.小烧杯中 B.洁净纸片上 C.托盘上
(2) 滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用____(填编号字母)作指示剂?
A.甲基橙 B.石蕊 C.酚酞
(3)在铁架台上垫一张白纸,其目的是_______ _?
(4)用0.20 mol·L-1的盐酸来滴定10.00 mL待测溶液,滴定终止时消耗盐酸溶液20.00mL,计算被测烧碱溶液的物质的量浓度是________mol·L-1,烧碱样品的纯度是________?
(5)下列实验操作:将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果 (填“偏高”?“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
碘溶于碘化钾溶液中形成I3—,并建立如下平衡:I3— I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
实验原理:
为了测定平衡时的c(I3—) ,可用过量的碘与碘化钾溶液一起摇动,达平衡后取上层清液用标准的Na2S2O3滴定:2 Na2S2O3 + I2 =" 2NaI" + Na2S4O6。
由于溶液中存在I3— I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
实验内容:
1.用一只干燥的100 mL 碘量瓶和一只250 mL碘量瓶,分别标上1、2号,用量筒取80 mL 0.0100 mol.L-1 KI于1号瓶,取200 mL 蒸馏水于2号瓶,并分别加入0.5 g过量的碘。
2.将两只碘量瓶塞好塞子,振荡30分钟,静置。
3.分别取上层清液20 mL用浓度为c mol/L标准Na2S2O3溶液进行滴定。1号瓶消耗V1 mL Na2S2O3溶液,2号瓶消耗V2 mL Na2S2O3溶液。
4.带入数据计算c(I3—)
试回答下列问题
(1)标准Na2S2O3溶液应装入 (填“酸式滴定管”或“碱式滴定管”),原因是 。
(2)碘量瓶在震荡静置时要塞紧塞子,可能的原因是
(3)滴定时向待测液中加入的指示剂是 ,到达滴定终点时的现象为 。
(4)用c 、V1和V2表示c(I3—)为 mol·L-1。
(5)若在测定1号瓶时,取上层清液时不小心吸入了少量的I2固体,则测定的c(I3—) (填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药等。某生产BaCO3、BaSO4的化工厂生产中排出大量的钡泥[主要含有BaCO3、BaSO3、Ba(FeO2)2等],该厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下:
已知: ①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9。
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式说明提纯原理: 。
(2)酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为 。
(3)该厂结合本厂实际,选用的X为 (填序号),中和I使溶液中的 (填离子符号)的浓度减小。
| A.BaCl2 | B.Ba(OH)2 | C.Ba(NO3)2 | D.BaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列金属防腐的措施中,使用外加电流的阴极保护法的是
| A.水中的钢闸门连接电源的负极 | B.金属护拦表面涂漆 |
| C.枪炮表面涂上一层油 | D.地下钢管连接镁块 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在100mLH2SO4和CuSO4的混合液中,用石墨做电极电解,两极上均收集到2.24L气体(标准状况下),则原混合液中,Cu2+的物质的量浓度为( )。
| A.1mol?L-1 | B.2mol?L-1 | C.3mol?L-1 | D.4mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断不正确的是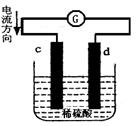
| A.电池工作的过程中,d电极上产生气泡 |
| B.电池工作时,溶液中SO42-向d移动 |
| C.c为负极,发生氧化反应 |
| D.电池工作的过程中,溶液中SO42-浓度基本不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com