
【题目】在2 L密闭容器中进行反应:mX(g)+nY(g)![]() pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
物质 时间 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2 min末/mol[ | 0.8 | 2.7 | 0.8 | 2.7 |
3 min末/mol | 0.8 |
已知2 min内v(Q)=0.075 mol·L-1·min-1,![]() ,试确定以下物质的相关量:
,试确定以下物质的相关量:
(1)起始时n(Y)=________,n(Q)=________。
(2)方程式中m=________,n=________,p=________,q=________。
(3)用Z表示2 min内的反应速率________。
【答案】
(1)2.3 mol 3 mol
(2)1 4 2 3
(3)0.05 mol·L -1·min -1
【解析】
试题分析:对比X的起始量和2 min末的量,可知反应逆向进行。
Δn(Q)=v(Q)·V·Δt=0.075 mol·L -1 ·min -1 ×2 L×2 min=0.3 mol。
对反应过程作三段式法分析如下:
mX + nY![]() pZ + qQ
pZ + qQ
始/mol 0.7 n(Y) 1 n(Q)
变/mol Δn(X) Δn(Y) Δn(Z) 0.3
2 min末/mol 0.8 2. 7 0.8 2.7
故Δn(X)=0.8 mol-0.7 mol=0.1 mol
Δn(Z)=1 mol-0.8 mol=0.2 mol
n(Q)=0.3 mol+2.7 mol=3 mol
(1)因![]() ,v(Y)=2v(Z)=
,v(Y)=2v(Z)= ![]() ×2=
×2= ![]() ×2= 0.1mol·L -1·min -1
×2= 0.1mol·L -1·min -1
所以Δn(Y)=0.1 mol·L -1 ·min -1 ×2 min×2 L=0.4 mol,
n(Y)=2.7 mol-0.4 mol=2.3 mol;n(Q)=0.3 mol+2.7 mol=3 mol。
(2)m∶n∶p∶q=Δn(X)∶Δn(Y)∶Δn(Z)∶Δn(Q)=0.1 mol∶0.4 mol∶0.2 mol∶0.3 mol=1∶4∶2∶3
(3)v(Q)=0.075 mol·L -1 ·min -1,故v(Z)=0.05 mol·L -1·min -1 。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】【化学——选修物质结构与性质】已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子。请回答下列问题:
(1)E元素基态原子的电子排布式为___________________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号)。
(3)D元素与氟元素相比,电负性:D_______________F(填“>”、“=”或“<”)。
(4)BD2在高温高压下所形成的晶体其晶胞如图所示。该晶体的类型属于___________________(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为_____________。l mol B2A2分子中含![]() 键的数目是_________________。
键的数目是_________________。
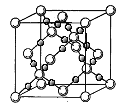
(5)光谱证实单质E与强碱溶液反应有[E(OH)4]—生成,则[E(OH)4]—中存在____________。
a.共价键 b.配位键 c.σ键 d.π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列用选、性质或变化对应正确的是
A.利用粮食酿酒的化学过程包含:淀粉→葡萄糖→→乙醇
B.在月饼包装袋中放入生石灰:防止食物氧化变质
C.焰火的绚丽:说明只有金属单质能发生焰色反应
D.氢氧化铝用于治疗胃酸过多:氢氧化铝碱性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有易溶强电解质的混合溶液10L,其中可能含有K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如下明所示,下列说法正确的是

A. 该溶液中能确定存在的离子是Ba2+、AlO2-、NH4+
B. 肯定不存在的离子是SO42-、OH-
C. 若不能确定的离子中至少还存在着一种阳离子,则该离子的最小浓度为0.2 mol/L
D. OA段反应的离子方程式:2 AlO2-+ CO2+3H2O=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠(NaCN)是重要的化工原料,常用于化学合成、冶金工业等。回答下列问题:
(1)下列标志中,应贴在装有氰化钠容器上的是 。

(2)写出NaCN的电子式 。
(3)可用纯碱、焦炭、氨气反应制取NaCN,写出反应的化学方程式,并用单线桥标明电子转移的方向和数目 。
(4)现代采金技术先以NaCN溶液在自然环境中浸取粉碎的含金(Au)矿石,得到Na[Au(CN)2](二氰合金酸钠)溶液,再用锌还原Na[ Au(CN)2]生成金。“浸取”反应的氧化剂是 ,消耗的锌与生成的金的物质的量之比为 。
(5)工业利用NaCN制备蓝色染料的流程如下:

通入Cl2时发生反应的离子方程式为_ _,该蓝色染料的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京和张家口市联合申办2022年冬奥会,目前北京市政府正在全力改善空气质量。以下不在空气质量报告范围内的是
A.O2 B.NO C.NO2 D.SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.含有共价键的化合物一定是共价化合物
B.在共价化合物中一定含有共价键
C.离子化合物中只含有离子键
D.化学键断裂的变化一定是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。

已知:①物质溶解性:LiF、CoCO3难溶于水,Li2CO3微溶于水;
② Co2O3有强氧化性,能氧化盐酸;
③ 部分金属离子形成氢氧化物沉淀的pH见下表:
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1) 步骤I中得到含铝溶液的反应的离子方程式是________________。
(2) 步骤D中加人盐酸的作用是________________。
(3) 步骤III中Na2CO3溶液的作用是调节溶液的PH,应使溶液的pH控制在_____(填范围),废渣I中的成分有________________。
(4) 步骤V中产生CoCO3的离子方程式是________________。
(5) 滤渣II用硫酸处理后用三室式电渗析法电解可得LiOH溶液和稀硫酸。则离子交换膜c为__________(填“阴”或“阳”)离子交换膜,随着电解的进行,阴极区pH将_________(填“增大”、“减小”或“不变”)。

(6) 向所得LiOH溶液中加入NH4HCO3即可得到Li2CO3。工业上以碳酸锂和碳酸钴在空气中高温煅烧制备锂离子电池的正极材料钴酸锂 (LiCoO2)时,还会产生一种三原子构成的直线型气体分子,该分子的电子式为_______________,写出工业上用上述方法制备钴酸锂的化学反应方程式___________________。
(7) 某锂离子充电时电池的总反应为C6+ LiCoO2==LixC6+Li1-xCoO2,该锂离子电池放电时正极的电极反应式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com