
【题目】氰化钠(NaCN)是重要的化工原料,常用于化学合成、冶金工业等。回答下列问题:
(1)下列标志中,应贴在装有氰化钠容器上的是 。

(2)写出NaCN的电子式 。
(3)可用纯碱、焦炭、氨气反应制取NaCN,写出反应的化学方程式,并用单线桥标明电子转移的方向和数目 。
(4)现代采金技术先以NaCN溶液在自然环境中浸取粉碎的含金(Au)矿石,得到Na[Au(CN)2](二氰合金酸钠)溶液,再用锌还原Na[ Au(CN)2]生成金。“浸取”反应的氧化剂是 ,消耗的锌与生成的金的物质的量之比为 。
(5)工业利用NaCN制备蓝色染料的流程如下:

通入Cl2时发生反应的离子方程式为_ _,该蓝色染料的化学式为 。
【答案】(1)A (2)![]()
(3)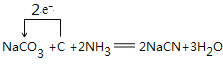
(4)氧气 1:2
(5)2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-;Fe3[Fe(CN)6]2
【解析】
试题分析:(1)NaCN是有剧毒的药品,应贴在装有氰化钠容器上的是剧毒标志,故选A;
(2)NaCN为离子化合物,电子式为![]() ;
;
(3)根据元素守恒可知,纯碱、焦炭、氨气反应制取 NaCN,同时会生成水,反应的化学方程式,并用单线桥标明电 子转移的方向和数目为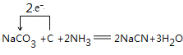 ;
;
(4)根据题意可知,NaCN溶液与Au以及空气中的氧气反应,Na[Au(CN)2]( 二氰合金酸钠)溶液,反应的化学方程式为4Au+8NaCN+2H2 O+O2=4Na[Au(CN)2]+4NaOH,所以氧化剂是氧气,还原1mol金要转移1mol电子,而每mol锌能转移2mol电子,所以消耗的锌与生成的金的物质的量之比为1:2;
(5)根据工业流程可知,NaCN与FeSO4反应生成Fe(CN)2白色沉淀,Fe(CN)2继续与NaCN溶液反应生成Na4[Fe(CN)6],Na4[Fe(CN)6]被氯气氧化成Na3[Fe(CN)6],反应的离子方程式为2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-,Na3[Fe(CN)6]与硫酸亚铁反应生成蓝色染料为Fe3[Fe(CN)6]2。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.标准状况下,11.2 L二氧化碳中所含有的氧原子数为NA
B.Na2O2与CO2反应产生1 mol O2,转移的电子数为4NA
C.0.1 mol/L氢氧化钠溶液中所含Na+数为0.1NA
D.18g的NH![]() 中含有的电子数为NA
中含有的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对一含有Al3+的未知溶液进行了如下分析:
①滴入少量氢氧化钠,无明显变化;
②继续滴加NaOH溶液,有白色沉淀;
③滴入过量的氢氧化钠,白色沉淀明显减少。实验小组经定量分析,得出如图所示沉淀与滴入氢氧化钠体积的关系。下列说法错误的是 ( )

A.该未知溶液中至少含有3种阳离子
B.滴加的NaOH溶液的物质的量浓度为5 molL-1
C.若另一种离子为二价阳离子,则a=10
D.若将最终沉淀过滤、洗涤、灼烧,其质量为6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中进行反应:mX(g)+nY(g)![]() pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
物质 时间 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2 min末/mol[ | 0.8 | 2.7 | 0.8 | 2.7 |
3 min末/mol | 0.8 |
已知2 min内v(Q)=0.075 mol·L-1·min-1,![]() ,试确定以下物质的相关量:
,试确定以下物质的相关量:
(1)起始时n(Y)=________,n(Q)=________。
(2)方程式中m=________,n=________,p=________,q=________。
(3)用Z表示2 min内的反应速率________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其制品在腐蚀介质中很容易被腐蚀,其使用寿命大为降低。因此只有对腐蚀介质中的金属及其制品采取防护措施,才能保证金属工艺设备的安全性和工农业生产顺利进行。下列对金属及其制品的防护措施中错误的是( )
A.铁锅用完后,用水刷去其表面的油污,置潮湿处保存
B.通过特殊工艺,增加铝制品表面的氧化膜厚度
C.对于易生锈的铁制品(如防护网)要定期涂刷防护漆
D.把Cr、Ni等金属加入到普通钢里制成不锈钢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的下列溶液,NH4+浓度最大的是( )
A. NH4Cl B. NH4HSO4 C. CH3COO NH4 D. NH4HCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是
A. Cu2+、Mg2+、SO42-、NO3- B. H+、Mg2+、SO42-、ClO-
C. Ag+、Na+、NO3-、Cl- D. NH4+、Ba2+、NO3-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水厂的水源水(原水)通常含有各种杂质,必须经过去除固体杂质和悬浮物、消毒、去除异味等一系列净化工序(即净化过程),才能达到使用标准.原水净化有下列措施:①过泣,②添加混视凝剂,③加入活性炭,④加入消毒剂。你认为正确的顺序是( )
A.①②③④ B.②①③④ C.②③①④ D.④①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com