
【题目】【化学——选修物质结构与性质】已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子。请回答下列问题:
(1)E元素基态原子的电子排布式为___________________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号)。
(3)D元素与氟元素相比,电负性:D_______________F(填“>”、“=”或“<”)。
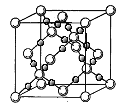
(4)BD2在高温高压下所形成的晶体其晶胞如图所示。该晶体的类型属于___________________(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为_____________。l mol B2A2分子中含![]() 键的数目是_________________。
键的数目是_________________。
(5)光谱证实单质E与强碱溶液反应有[E(OH)4]—生成,则[E(OH)4]—中存在____________。
a.共价键 b.配位键 c.σ键 d.π键
【答案】(15分)(1)1s22s22p63s23p1(2分)(2)C、O、N (2分)
(3)< (2分)(4) 原子 sp3 3NA(或1.806×1024)(各2分)(5) abc(3分)
【解析】试题分析:A、B、C、D、E五种元素的原子序数依次增大,B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍,则B原子核外有6个电子,则B为碳元素;D原子L层上有2对成对电子,则D原子电子排布式为1s22s22p4,所以D为氧元素;C原子序数介于碳元素与氧元素之间,则C为氮元素;原子序数A<B,B为碳元素,A原子的最外层电子数等于其周期序数,则A为氢元素;E原子的最外层电子数等于其周期序数,E原子的电子层数是A的3倍,E为铝元素;所以A为氢元素;B为碳元素;C为氮元素;D为氧元素;E为铝元素;
(1)E为铝元素,原子核外有13个电子,基态原子的电子排布式为1s22s22p63s23p1;
(2)B为碳元素;C为氮元素;D为氧元素,同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C,由于氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以B、C、D三种元素的第一电离能数值由小到大的顺序为C、O、N;
(3)D为氧元素,同周期自左而右电负性增大,所以电负性O<F;
(4)BD2是CO2,由晶体结构图可知,大球为碳原子,小球为氧原子,每个碳原子周围有4个氧原子,每个氧原子周围有2个碳原子,晶体中不存在CO2分子,故在高温高压下所形成的晶体为原子晶体,该晶体中C原子轨道的杂化数为4,碳原子采取sp3杂化;B2A2为C2H2,C2H2的结构式为H-C≡CH,单键为δ键,三键含有1个δ键、2个π键,1个C2H2分子中含有3个δ键,所以l molC2H2分子中含σ键的数目是3 NA(或1.806×1024);
(5)E为铝元素,光谱证实单质E与强碱溶液反应有[Al(OH)4]-生成,[Al(OH)4]-中氧原子与氢原子之间为共价键,是单键,属于δ键,铝离子与氢氧根离子之间形成配位键,配位键也属于共价键.所以,[Al(OH)4]-中存在共价键、配位键、δ键;故选abc。


科目:高中化学 来源: 题型:
【题目】下列物质性质的比较,不能用元素周期律解释的是
A. 稳定性:H2O > NH3 B. 碱性:NaOH > Al(OH)3
C. 氧化性:F2 >Cl2 D. 酸性:CH3COOH > H2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修化学与技术】
(1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。
①“氨碱法”产生大量CaCl2废弃物,写出该工艺中产生CaCl2的化学方程式:_________________;
②写出“联合制碱法”有关反应的化学方程式:_____________________;
③CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?_________________;
(2)钢铁工业对促进经济和社会发展起了重要作用。
① 炼钢时,加入硅、锰和铝的目的是_______________________________。
② 不锈钢含有的Cr元素是在炼钢过程的氧吹____________(填“前”或“后”)加入。
③ 炼铁和炼钢生产中,尾气均含有的主要污染物是________。从环保和经济角度考虑,上述尾气经处理可用作__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学方程式:C(石墨,s)+2H2(g)===CH4(g),ΔH=a
2C(石墨,s)+H2(g)===C2H2(g),ΔH=b
2C(石墨,s)+2H2(g)===C2H4(g),ΔH=c
已知:a>c>b,对下列反应:C2H2(g)+H2(g)===C2H4(g),ΔH=x
2CH4(g)===C2H4(g)+2H2(g) ,ΔH=y,下列判断正确的是
A.x>0,y<0 B.x<0,y>0 C.x>0,y>0 D.x<0,y<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】山西被称为煤海,欲提高煤的燃烧效率,下列说法正确的是( )
A.将煤粉碎后燃烧
B.通入大量的空气
C.加入的煤越多越好
D.将煤和空气在密闭的空间里燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中进行反应:mX(g)+nY(g)![]() pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
物质 时间 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2 min末/mol[ | 0.8 | 2.7 | 0.8 | 2.7 |
3 min末/mol | 0.8 |
已知2 min内v(Q)=0.075 mol·L-1·min-1,![]() ,试确定以下物质的相关量:
,试确定以下物质的相关量:
(1)起始时n(Y)=________,n(Q)=________。
(2)方程式中m=________,n=________,p=________,q=________。
(3)用Z表示2 min内的反应速率________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com