
【题目】在体积都为1L,pH都等于2的盐酸和醋酸溶液中,投入0.65g锌粒。则下图所示比较符合客观事实的是

【答案】C
【解析】
试题分析:体积都为1L,pH都等于2的盐酸和醋酸溶液中,n(CH3COOH)>n(HCl)=0.01mol,0.65g锌粒的物质的量= ![]() =0.01mol,锌和酸反应Zn+2H+=Zn2++H2↑,盐酸酸溶液中氢离子不足,锌剩余0.005mol,醋酸溶液中存在电离平衡,平衡状态下的氢离子不足,但随着反应进行,醋酸又电离出氢离子进行反应,放出的氢气一定比盐酸多,开始时由于氢离子浓度相同,开始的反应速率相同,反应过程中醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,所以反应速率快;反应后,醋酸有剩余,导致醋酸溶液中pH小于盐酸溶液中;A.产生氢气的量从0开始逐渐增多,最终由于醋酸电离平衡的存在,生成氢气的量比盐酸多,反应过程中氢离子浓度大于盐酸溶液中氢离子浓度,和同量锌反应速率快,故图象不符合题意,故A错误;B.反应开始氢离子浓度相同,反应速率相同.曲线从相同速率开始反应,但醋酸溶液中存在电离平衡,反应过程中醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,所以醋酸溶液反应过程中反应速率快,所以图象不符合题意,故B错误;C.刚开始时,溶液的pH值为2,由于醋酸电离平衡的存在,反应过程中氢离子浓度大于盐酸溶液中氢离子浓度,所以醋酸反应速率始终大于盐酸反应速率,反应后,醋酸有剩余,所以生成的氢气的量比盐酸多,故C正确;D.反应开始氢离子浓度相同,反应过程中醋酸存在电离平衡,醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,故D错误;故选C。
=0.01mol,锌和酸反应Zn+2H+=Zn2++H2↑,盐酸酸溶液中氢离子不足,锌剩余0.005mol,醋酸溶液中存在电离平衡,平衡状态下的氢离子不足,但随着反应进行,醋酸又电离出氢离子进行反应,放出的氢气一定比盐酸多,开始时由于氢离子浓度相同,开始的反应速率相同,反应过程中醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,所以反应速率快;反应后,醋酸有剩余,导致醋酸溶液中pH小于盐酸溶液中;A.产生氢气的量从0开始逐渐增多,最终由于醋酸电离平衡的存在,生成氢气的量比盐酸多,反应过程中氢离子浓度大于盐酸溶液中氢离子浓度,和同量锌反应速率快,故图象不符合题意,故A错误;B.反应开始氢离子浓度相同,反应速率相同.曲线从相同速率开始反应,但醋酸溶液中存在电离平衡,反应过程中醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,所以醋酸溶液反应过程中反应速率快,所以图象不符合题意,故B错误;C.刚开始时,溶液的pH值为2,由于醋酸电离平衡的存在,反应过程中氢离子浓度大于盐酸溶液中氢离子浓度,所以醋酸反应速率始终大于盐酸反应速率,反应后,醋酸有剩余,所以生成的氢气的量比盐酸多,故C正确;D.反应开始氢离子浓度相同,反应过程中醋酸存在电离平衡,醋酸溶液中的氢离子浓度始终比盐酸溶液中的氢离子浓度大,故D错误;故选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】200 mL硝酸与一定量铝铁合金反应生成 3.36 L NO(标况),向反应后的溶液中加入150 mL 3 mol·L1的NaOH溶液,使铝铁元素恰好全部转化为沉淀,则原硝酸的浓度是
A.3 mol·L1 B.2.25 mol·L1 C.1. 5 mol·L1 D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列有关叙述正确的是( )
A. 标况下,11.2L氟化氢中含有的分子数目为0.5NA
B. 室温下,21.0g乙烯和丁烯的混合气体中所含的碳原子数目是NA
C. 室温下,2L 0.05mol/L的NH4NO3溶液中所含有的氮原子数目是0.2NA
D. 22.4L Cl2与足量NaOH溶液反应时转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产、可持续发展密切相关,下列说法正确的是
A. 14C可用于文物年代的鉴定,14C和12C互为同素异形体
B. 在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因
C. 现代工业生产中芳香烃主要来源于石油化工的催化重整和煤的干馏
D. 高纯度的SiO2可以制成光电池将光能直接转换为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F、G、H、M九种物质,其中A为淡黄色粉末,G为黄绿色气体单质,E为无色气体单质,F的水溶液与石灰水混合可得D的溶液,它们之间的相互转化关系如图所示,其他与题无关的生成物均已略去。

请回答下列问题:
(1)写出E、H的化学式:E ,H 。
(2)写出①、⑤的化学方程式:
① ,⑤ 。
(3)写出③的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为达到下列实验目的,所采用的方法合理的是
A. 溴水中提取溴:分液
B. 分离水和汽油的混合物:蒸馏
C. 分离饱和食盐水和沙子的混合物:过滤
D. 从硝酸钾和氯化钠混合液中获取硝酸钾:萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu粉放入稀H2SO4中,加热后无现象,当加入一种盐后,Cu粉质量减少,而溶液变蓝,同时有气体生成,此盐是( )
A.氯化物
B.硫酸盐
C.硝酸盐
D.碳酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
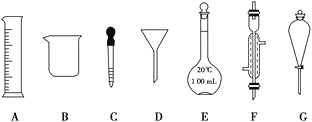
(1)写出仪器名称:D________,F________。
(2)下列实验操作中用到仪器G的是________(填下列选项的编号字母)。]
a.分离水和CCl4的混合物 b.分离水和酒精的混合物 c.分离水和泥沙的混合物
(3)实验室需要配制450mL 0.4 mol/L的硫酸溶液。
①配制时,实验室提供了以下仪器:烧杯、100mL量筒、玻璃棒、托盘天平(带砝码)、胶头滴管,还缺少的玻璃仪器是 。上述实验中使用容量瓶前必须进行的操作是
②配制该溶液需用98﹪的浓硫酸(密度为1.8g/mL)___________mL。取用该体积浓硫酸时,需要用到上述仪器中的A和___________(填仪器的编号字母)。
③下列操作会使配制的溶液浓度偏高的是________(填下列选项的编号字母)。
A.转移过程中有少量溶液溅出 |
B.没有冷却,立即转移到容量瓶中定容 |
C.摇匀后,液面下降,补充水 |
D.定容时俯视刻度线 |
E.量筒量取浓硫酸是仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修物质结构与性质】已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子。请回答下列问题:
(1)E元素基态原子的电子排布式为___________________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号)。
(3)D元素与氟元素相比,电负性:D_______________F(填“>”、“=”或“<”)。
(4)BD2在高温高压下所形成的晶体其晶胞如图所示。该晶体的类型属于___________________(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为_____________。l mol B2A2分子中含![]() 键的数目是_________________。
键的数目是_________________。
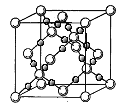
(5)光谱证实单质E与强碱溶液反应有[E(OH)4]—生成,则[E(OH)4]—中存在____________。
a.共价键 b.配位键 c.σ键 d.π键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com