
 ,
, .
.


科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放热反应的反应速率总是大于吸热反应的反应速率 |
| B、反应放热还是吸热必须看反应物和生成物具有的总能量的相对大小 |
| C、放热反应在常温下一定很容易发生 |
| D、已知石墨(s)比金刚石(s)稳定,则石墨(s)转变为金刚石(s)要放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭. |
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10倍 | ||
| B、20倍 | ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水电离:NH3?H2O=NH4++OH- |
| B、碳酸钙电离:CaCO3?Ca2++CO32- |
| C、硫酸铝水解:Al3++2H2O=Al(OH)3↓+3OH- |
| D、AgCl的沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:
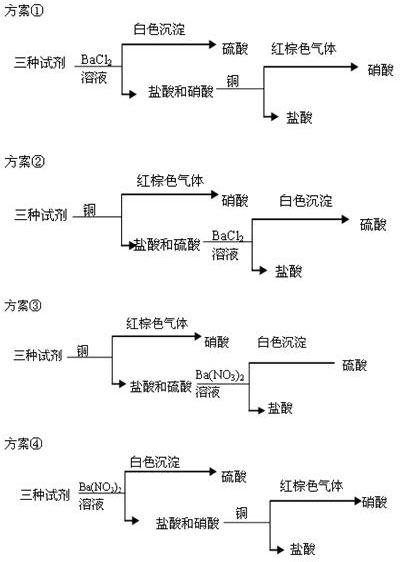
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com