
【题目】钴是一种中等活泼金属,化合价为+2 价和+3 价,其中 CoCl2易溶于水.某校同学设计实验制取(CH3COO )2Co( 乙酸钴)并验证其分解气体产物.问答下列问题:
(1)甲同学用 Co2O3 与盐酸反应制备CoCl2·4H2O其实验装置如下:
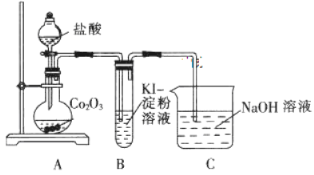
①已知 B 装置中溶液变蓝, 写出烧瓶中发生反应的离子方程式为 _____________。
②由烧瓶中的溶液制取干燥的CoCl2·4H2O,还需经过的操作有蒸发浓缩、__________、洗涤、干燥等。
(2)乙同学利用甲同学制得的CoCl2·4H2O 在醋酸氛围中制得无水(CH3COO)2Co。已知(CH3COO)2Co![]() Co3O4 +CO↑+ CO2↑+ X↑, 该同学称取一 定量的无水(CH3COO )2Co,利用下列装置检验(CH3COO )2Co分解的气体产物(实验过程中同时通入N2),并测定X 的化学式。已知PdCl2溶液可用于检验CO ,它能将CO氧化成 CO2。
Co3O4 +CO↑+ CO2↑+ X↑, 该同学称取一 定量的无水(CH3COO )2Co,利用下列装置检验(CH3COO )2Co分解的气体产物(实验过程中同时通入N2),并测定X 的化学式。已知PdCl2溶液可用于检验CO ,它能将CO氧化成 CO2。
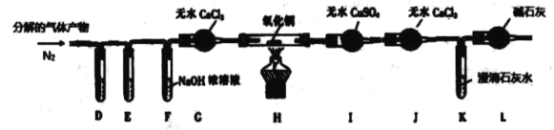
①装置D、E 是用于检验CO 和 CO2的 ,其中盛放PdCl2 溶液的是装置_____(填“D”或“E”)。
②装置F 的作用是__________; 装置L 的作用是__________。
③已知 X 为 二元化合物.假设实验中的每一步反应均完全,实验中观察到装置H 中氧化铜变红,装置I中固体变成蓝色且增重5.4g, K 中石灰水变浑浊且增重8.8g,则X的化学式为_______,写出(CH3COO )2Co 热分解的化学反应化学方程式_______。
【答案】Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O 冷却结晶、过滤 E 吸收二氧化碳 防止空气中的二氧化碳进入装置K C2H6 ![]()
【解析】
(1)①B装置中溶液变蓝,说明产生氯气,则烧瓶中发生反应的离子方程式为Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O,故答案为:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O。
②制取干燥的CoCl2·4H2O,需经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等,故答案为:冷却结晶、过滤;
(2)①由于PdCl2溶液能将CO氧化成 CO2,则应先检验二氧化碳,所以盛放PdCl2 溶液的是装置E,故答案为:E;
②装置F中盛装的是氢氧化钠,能将二氧化碳吸收,防止对后面实验的干扰;装置L中装有碱石灰,可以防止空气中的二氧化碳进入装置K,避免对装置K检验二氧化的干扰,故答案为:吸收二氧化碳;防止空气中的二氧化碳进入装置K;
③装置I中固体变成蓝色且增重5.4g,则n(H2O)=![]() ,K中石灰水变浑浊且增重8.8g,则n(CO2)=
,K中石灰水变浑浊且增重8.8g,则n(CO2)=![]() ,
,![]() ,即X的化学式为C2H6,(CH3COO )2Co 热分解的化学反应化学方程式为
,即X的化学式为C2H6,(CH3COO )2Co 热分解的化学反应化学方程式为![]() ,故答案为:C2H6;
,故答案为:C2H6;![]() 。
。


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1molCl-、ClO![]() (x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是( )
(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是( )
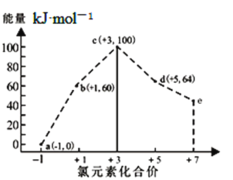
A.a、b、c、d、e中,c最稳定
B.b→a+c反应的活化能为60kJ·mol-1
C.b→a+d反应的热化学方程式为3ClO-(aq)=ClO![]() (aq)+2Cl-(aq)△H=-116kJ·mol-1
(aq)+2Cl-(aq)△H=-116kJ·mol-1
D.e是ClO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 氨分子是三角锥形,而甲烷是正四面体形,是因为NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
B. 杂化轨道全部参加形成化学键
C. PCl5分子中P原子和Cl原子最外层都满足8电子结构
D. 在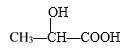 分子中含有2个手性C原子
分子中含有2个手性C原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(用NA表示阿伏加德罗常数的值)
A. 17g羟基(-OH)所含有的电子数是10 NA个
B. 常温下,14g乙烯含有的共用电子对数是2.5NA个
C. 12 g石墨中含有C﹣C键的个数为1.5NA
D. 标准状况下,CH4发生取代反应生成22.4LCH2Cl2,需要消耗2NA个Cl2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为2NaNH2+N2O==NaN3+NaOH+NH3,3NaNH2+NaNO3==NaN3+3NaOH+NH3↑。
回答下列问题:
(1)氮元素所在的周期中,电负性最大的元素是________,第一电离能最小的元素是_______。
(2)基态氮原子的L层电子排布图为_________________。
(3)与N3-互为等电子体的分子为_________(写出一种)。依据价层电子对互斥理论,NO3-的空间构型是______________,其中心原子杂化类型是__________。
(4)叠氮化钠中不含有的化学键类型有_____________。
A.离子键 B.极性共价键 C.σ键 D.π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究煤的合理利用及 CO2的综合应用有着重要的意义。请回答以下问题:
I.煤的气化
已知煤的气化过程涉及的基本化学反应有:
①C(s)+H2O(g) ![]() CO(g)+H2(g) △H=+131kJ·mol-1
CO(g)+H2(g) △H=+131kJ·mol-1
②CO(g)+3H2(g) ![]() CH4(g) +H2O(g) △H=akJ·mol-1
CH4(g) +H2O(g) △H=akJ·mol-1
查阅资料反应②中相关化学键能数据如下表:
化学键 | C≡O | H—H | H—C | H—O |
E(kJ·mol-1) | 1072 | 436 | 414 | 465 |
(1)则反应②中 a =_____________。
(2)煤直接甲烷化反应 C(s) + 2 H2 (g) ![]() CH4(g) 的△H=为 _____kJ mol-1, 该反应在_____________(填“高温”或“低温 ”)下自发进行。
CH4(g) 的△H=为 _____kJ mol-1, 该反应在_____________(填“高温”或“低温 ”)下自发进行。
II.合成低碳烯烃
在体积为1 L 的 密闭容器中,充入 1mol CO2和 2 .5 mol H2, 发生 反应: 2CO2 ( g) + 6 H2(g)![]() C2H4(g)+4 H2O(g) △H=-128kJ·mol-1,测得温度对催化剂催化效率和CO2 平衡转化率的影响如右图 所 示 :
C2H4(g)+4 H2O(g) △H=-128kJ·mol-1,测得温度对催化剂催化效率和CO2 平衡转化率的影响如右图 所 示 :
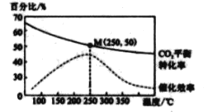
(3) 图中低温时, 随着温度升高催化剂的催化效率提高, 但 CO2的平衡转化率却反而降低 ,其原因是_______________.
(4) 250℃时,该反应的平衡常数K 值为____________。
III.合成甲醇
在恒温 2 L 容积不变的密闭容器中,充入 1molCO2 和 3 molH2, 发生反应:. CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
CH3OH(g)+ H2O(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
p后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
(5) 反应前 1 小时内的平均反应速率 v(H2)为_______molL-1h-1 , 该温度下CO2的平衡转化率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要“打赢蓝天保卫战”,意味着对污染防治比过去要求更高。某种利用垃圾渗透液实现发电、环保二位一体相结合的装置示意图如图,当该装置工作时,下列说法正确的是( )
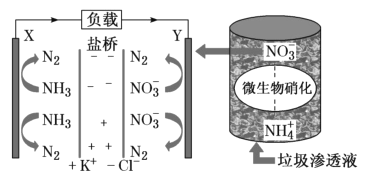
A.盐桥中K+向X极移动
B.电路中流过7.5mol电子时,共产生标准状况下N2的体积为44.8L
C.该装置实现了将电能转化为化学能
D.Y极发生的反应为2NO3--10e-+6H2O=N2↑+12OH-,周围pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。
回答下列问题:
(1)基态Ti原子4s轨道上的一个电子激发到4p轨道上形成激发态,写出该激发态价层电子排布式__。第三电离能:Ca__Ti(填“大于”或“小于”)。
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
①Cl2O2的沸点比H2O2低,原因是__。
②O3分子的中心原子杂化类型为___;与O3互为等电子体的是__(任意写一种)。
(3)Na3OCl可由以下方法制得:2Na+2NaOH+2NaCl![]() 2Na3OCl+H2↑,在该反应中,形成的化学键有__(填标号)。
2Na3OCl+H2↑,在该反应中,形成的化学键有__(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(4)Na3OCl晶体属于立方晶系,其晶胞结构如图所示。已知:晶胞参数为anm,密度为dgcm3。

①Na3OCl晶胞中,O位于各顶点位置,Cl位于__位置。
②用a、d表示阿伏加德罗常数的值NA=__(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室常用的几种气体发生装置如图A、B、C所示。
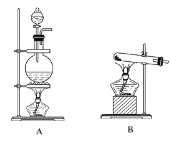
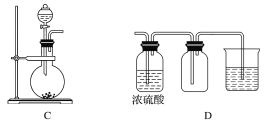
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的试剂是_________;
检查C装置的气密性是否良好的操作方法是____________________________。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
如图是某学生设计收集气体的几种装置,其中不可行的是________。
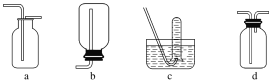
(3)若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的________。
①CO2 ②NO ③Cl2 ④H2
II.镁与稀硝酸的反应为:Mg+HNO3(稀)——Mg(NO3)2+NO↑+H2O(未配平)
(4)该反应中,还原产物是_________,HNO3表现了___________(选填“还原性”、“氧化性”、“酸性”、“碱性”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com