
| n(Na2CO3) |
| n(NaHCO3) |
| A、a=1则c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| B、a=2则c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C、a为任意值时,则c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| D、a=0则c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| n(Na2CO3) |
| n(NaHCO3) |
| n(Na2CO3) |
| n(NaHCO3) |


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
| A、2c(K+)=c(HCO3-)+2c(CO32-)+c(H2CO3) |
| B、c(Na+)>c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| C、c(OH-)+c(CO32-)=c(H+)+c(H2CO3)+0.1mol?L-1 |
| D、3c(K+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3、NaCl、AgNO3 |
| B、Na2SO4、NaOH、HCl |
| C、CuSO4、Na2SO4、NaNO3 |
| D、K2SO4、KNO3、KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
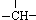 ,其余为-NH2,则-NH2的数目可能是( )
,其余为-NH2,则-NH2的数目可能是( )| A、2n+3-m |
| B、a+2-m |
| C、n+m+a |
| D、a+2n+2-m |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
| A、Fe3+、Cu2+、Cl-、NO3- |
| B、Fe2+、K+、SO42-、NO3- |
| C、Cu2+、Na+、CO32-、SO42- |
| D、Fe2+、K+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、黄绿色的氯水光照后颜色变浅 |
| B、由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 |
| C、温度过高对合成氨不利 |
| D、溴水中有平衡:Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL 0.4mol/L KNO3溶液 |
| B、100mL 0.2mol/L Cu(NO3)2溶液 |
| C、200mL 0.1mol/L Fe(NO3)2溶液 |
| D、400mL 0.1mol/L Al(NO3)3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com