
| A、2c(K+)=c(HCO3-)+2c(CO32-)+c(H2CO3) |
| B、c(Na+)>c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| C、c(OH-)+c(CO32-)=c(H+)+c(H2CO3)+0.1mol?L-1 |
| D、3c(K+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
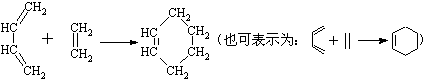

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
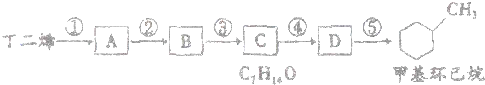
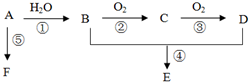 已知A是一种相对分子质量为28的气态烃,它可转化为其他常见有机物,转化关系如图所示.
已知A是一种相对分子质量为28的气态烃,它可转化为其他常见有机物,转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色透明的溶液:Fe3+、K+、OH-、NO3- |
| B、与Al反应生成H2的溶液:Na+、Ma2+、NO3-、HCO3- |
| C、c(OH-)=1mol/L的溶液:K+、Ca2+、Cl-、H2SO3 |
| D、CH3COOH:SO42-、Cl-、Cu2+、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编 号 | A | B | C | D |
| X的化学式 | Na | Na2O | Na2O2 | NaOH |
| 加入X的质量(g) | 2.3 | 6.4 | 7.8 | 16.0 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶解度:Na2CO3大于NaHCO3 |
| B、稳定性:Na2CO3大于NaHCO3 |
| C、与酸反应剧烈程度:NaHCO3大于Na2CO3 |
| D、石灰水可与Na2CO3反应而不与NaHCO3反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(Na2CO3) |
| n(NaHCO3) |
| A、a=1则c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| B、a=2则c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C、a为任意值时,则c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| D、a=0则c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com