
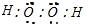 ,是共价化合物,丁为过氧化钠,它的电子式为
,是共价化合物,丁为过氧化钠,它的电子式为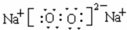 ,是离子化合物,
,是离子化合物,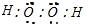 ;
;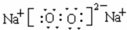 ;共价化合物;离子化合物;
;共价化合物;离子化合物;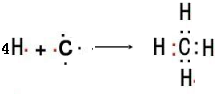 ;
;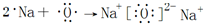 ,
,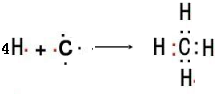 ;
;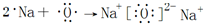 ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、NH4+、K+、OH-、HCO3- |
| B、Na+、Cl一、Ba2+、CO32- |
| C、H+、Al3+、Ag+、NO3- |
| D、H+、Na+、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向碳酸氢镁溶液中加人过量氢氧化钠Mg2++2HCO3-+2OH-→MgCO3↓+2H2O+CO32- |
| B、Fe2O3溶于过量的氢碘酸中:Fe2O3+6H+→2Fe3++3H2O |
| C、向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全Ba2++2OH-+NH4++H++SO42-→BaSO4↓+NH3?H2O+H2O |
| D、大理石溶于醋酸:CaCO3+2CH3COOH→Ca2++2CH3COO-+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/(kJ?mol-1) | I1 | I2 | I3 | I4 | I5 |
| Y | 584 | 1 823 | 2 751 | 11 584 | 14 837 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H2 |
| B、HOCH2CH2OH |
| C、C2H6O |
| D、CH3OCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2c(K+)=c(HCO3-)+2c(CO32-)+c(H2CO3) |
| B、c(Na+)>c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| C、c(OH-)+c(CO32-)=c(H+)+c(H2CO3)+0.1mol?L-1 |
| D、3c(K+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com